
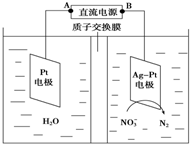
| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
分析 根据图知,电解过程中NO3-得电子被还原生成N2,所以Ag-Pt电极为阴极,则Pt电极为阳极,所以A是正极、B是负极,铅蓄电池中,Pb作负极、正极为PbO2,电解过程中使用的是质子交换膜,所以右侧电解质溶液呈酸性,结合转移电子和氮气之间的关系式计算.
解答 解:根据图知,电解过程中NO3-得电子被还原生成N2,所以Ag-Pt电极为阴极,则Pt电极为阳极,所以A是正极、B是负极,铅蓄电池中,Pb作负极、正极为PbO2,
A.通过以上分析知,B为负极,电极材料是Pb,故A错误;
B.铅蓄电池放电过程中,负极反应式为Pb-2e-+SO42-=PbSO4 ,所以电极材料质量增加,故B正确;
C.电解质溶液呈酸性,阴极电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故C错误;
D.根据2NO3-+12H++10e-=N2↑+6H2O知,转移10mol电子式生成1mol氮气,则生成氮气的体积在标况下是22.4L,故D错误;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是D,注意气体摩尔体积适用范围及适用条件,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
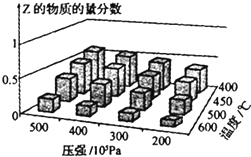 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜有毒 | B. | 硫酸铜溶液是蓝色的胶体 | ||
| C. | 硫酸铜为电解质 | D. | 解毒的原因是Cu2+转化为沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发、洗涤 | B. | 溶解、蒸发、洗涤、过滤 | ||
| C. | 溶解、过滤、洗涤、干燥 | D. | 溶解、洗涤、过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
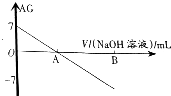 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-5 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com