
 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.

 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、7.8 gNa2O2与足量的水反应,转移的电子数为0.1NA |
| B、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C、25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D、100mL 12 mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Al3+、Fe3+ |
| 阴离子 | Cl-、NO3-、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Z元素的原子半径可能比Y元素的小 |
| B、W的原子序数可能是Y的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的化学活泼性一定比X强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
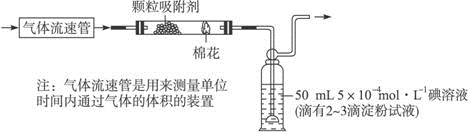

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com