
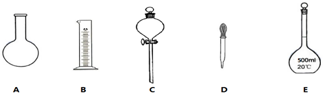
分析 (1)配制溶液需要五种玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、容量瓶;
(2)①因无450 mL的容量瓶,配制NaOH溶液要用500 mL的容量瓶,根据m(NaOH)=c•V•M计算出需要氢氧化钠的质量;
②洒落了少量溶液,导致配制的溶液中溶质的物质的量偏小,溶液的浓度偏低;
③NaOH溶于水放出大量热,应把它冷却至室温后再移入容量瓶中,否则定容后,溶液冷却到室温后,体积减小,浓度偏高;
解答 解:(1)配制该溶液需要用到的玻璃仪器为:量筒、烧杯、玻璃棒、胶头滴管、容量瓶,所以不需要为仪器为AC;还缺少的玻璃仪器为:烧杯和玻璃杯,
故答案为:AC;烧杯、玻璃棒;
(2)①因无450 mL的容量瓶,配制NaOH溶液要用500 mL的容量瓶,m(NaOH)=c•V•M=0.1 mol•L-1×0.5 L×40 g•mol-1=2.0 g,
故答案为:2.0;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液中溶质的物质的量偏小,溶液浓度偏低,小于0.1mol/L,
故答案为:<;
③NaOH溶于水放出大量热,应把它冷却至室温后再移入容量瓶中,否则定容后,溶液冷却到室温后,体积减小,浓度偏高,
故答案为:>.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.


科目:高中化学 来源: 题型:选择题
| A. | 19 | B. | 53 | C. | 72 | D. | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,转移1 mol电子时阴极增加的质量为103.5 g | |
| C. | 放电时,BF4-向PbO2电极移动 | |
| D. | 放电时,正极的电极反应式为Pb+2e-+2H2O═Pb2++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 在过氧化钠中加入稀硫酸:O22-+4H+═2H2O+O2↑ | |
| C. | 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比4:1 | B. | 分子数之比为4:11 | ||
| C. | 体积比11:4 | D. | 物质的量之比为4:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用甲醇、乙醇混合型汽油可以减少对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 LCCl4含有的分子数为0.25NA | |
| B. | 常温常压下,8g CH4含有的分子数为0.5NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com