
| ||


| ||
| ||


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
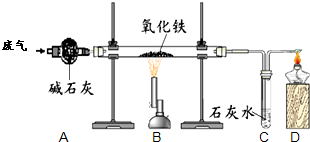 某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.
某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.
某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、步骤(1)需要用到过滤装置 |
| B、步骤(2)需要用到分液装置 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)需要用到布氏漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1869年俄国化学家门捷列夫发现了元素的性质随着原子序数的递增而呈周期性变化的规律 |
| B、1913年丹麦物理学家玻尔提出,原子核外的电子在一系列稳定的轨道上运动会吸收能量和放出能量 |
| C、1923年化学家提出了酸碱质子理论,凡是能给出质子的物质是酸,能接受质子的物质是碱,那么H2O可看作两性物质 |
| D、1940年我国化学专家侯德榜发明了侯氏制碱法,将NH3通往CO2的NaCl饱和溶液中生成溶解度较小的NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com