


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、加催化剂,V正和V逆都发生变化,且变化的倍数相等 |
| B、增大压强,V正和V逆都增大,且V正增加倍数大于V逆增加倍数 |
| C、降低温度,V正和V逆都减少,且V逆减少倍数大于V正减少倍数 |
| D、通入氩气,V正和V逆都增大,且V正增加倍数大于V逆增加倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
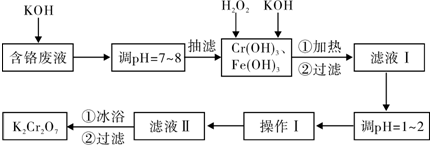
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
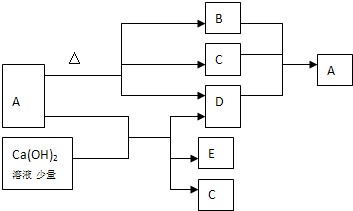
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂的种类很多,但它们水解后都一定有一产物相同 | ||
| B、淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体 | ||
C、已知CH4+H2O
| ||
| D、C(CH3)4的二氯代物只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com