
下列物质:①BeCl2 ②SiC ③白磷 ④BF3 ⑤NH3 ⑥过氧化氢 , 其中含极性键的非极性分子是
A.①③④ B.②③⑥ C.①④ D.①③④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和SiO2等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
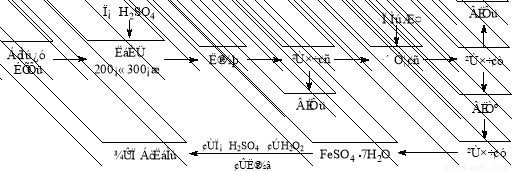
(1)实验室实现“操作I”所用的玻璃仪器有玻璃棒、 和烧杯;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 ,检验“酸溶”后的溶液中含有Fe2+的试剂及现象是 ;
(3)“操作Ⅲ”系列操作名称依次为 、冷却结晶、过滤和洗涤。洗涤沉淀的方法是 ;
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL2mol·L-1NaCl溶液和100mL0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol·L-1
D.10g98%的硫酸(密度为1.84g·cm—3)与10mL18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列关于平衡常数的说法中,正确的是
A.化学平衡常数用来定量描述化学反应的限度
B.利用化学平衡常数判断化学反应进行的快慢
C.平衡常数的大小与温度、浓度、压强、催化剂有关
D.对于一个化学反应达到平衡之后,若只改变一个因素使得平衡发生移动,则K值一定变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高二上学期期中测试化学试卷(解析版) 题型:填空题
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数。 |
Y | 原子核外的L层有3个未成对电子。 |
Z | 在元素周期表的各元素中电负性仅小于氟。 |
Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | 原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O
D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州市高一上学期期中测试化学试卷(解析版) 题型:选择题
将0.2molMnO2和含0.6molHCl的浓盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量(不考虑盐酸的挥发)
A.一定等于0.3mol B.一定小于0.3mol
C.一定大于0.3mol D.可能等于0.3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州市高一上学期期中测试化学试卷(解析版) 题型:选择题
含有NaBr、NaI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是
A.NaCl B.NaCl和NaBr C.NaCl和NaI D.NaCl和I2
查看答案和解析>>
科目:高中化学 来源:2016届浙江省深化课程改革协作校高三上学期11月期中联考化学试卷(解析版) 题型:填空题
(1)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= -a kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = -b kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = -c kJ•mol-1
CH3OH(g) △H3 = -c kJ•mol-1
计算甲醇蒸气的标准燃烧热?H=
(2)①As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
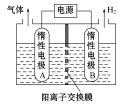
②利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
③利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
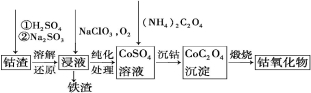
Co(OH)3溶解还原反应的离子方程式为 。
查看答案和解析>>
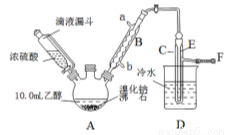
科目:高中化学 来源:2016届广东省中山市等七校联合体高三上学期12月联合化学试卷(解析版) 题型:实验题
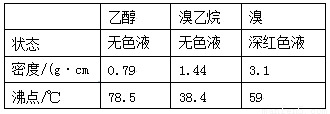
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑
NaHSO4+HBr↑
CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
(1)A装置的名称是 。
(2)实验中用滴液漏斗代替分液漏斗的优点为 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式 。
(4)给A加热的目的是 ,F接橡皮管导入稀NaOH溶液,其目的主要是 。
(5)图中C中的导管E的末端须在水面以下,其目的是 。
(6)为了除去产品中的主要杂质,最好选择下列____________(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的___________(上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com