
【题目】按要求填空:
(1)分子中含有14个氢原子的烷烃的名称是 .
(2)正丁烷,异丁烷,正戊烷三种物质,按沸点由高到低顺序排列为 (用结构简式表示).
(3)相对分子质量为72的烷烃分子式为 ,它的同分异构体的结构简式为 .
(4)某烃完全燃烧生成的二氧化碳与水的物质的量比为2:3,则该烃的结构式为 .
(5)在丙烷、乙烯、苯、丁烯四种物质中,不能使酸性高锰酸钾溶液褪色的物质结构简式是 .
【答案】(1)己烷;
(2)CH3﹣CH2﹣CH2﹣CH2﹣CH3>CH3CH2CH2CH3>(CH3)2CHCH3,
(3)C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4;
(4)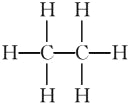 ;
;
(5)CH3CH2CH3和![]() .
.
【解析】
试题分析:(1)根据烷烃的通式CnH2n+2来计算;
(2)烷烃相对分子质量越大,沸点越高,同分异构体中,含支链越多,沸点越低;
(3)根据烷烃的组成通式CnH2n+2确定碳原子数目,书写该烷烃的分子式,根据主链减碳作为取代基进行书写戊烷的异构体;
(4)有机物完全燃烧生成二氧化碳和水的物质的量之比为2:3,根据C、H原子守恒知,该有机物中C、H原子个数之比=2:6;
(5)不饱和烃以及甲苯可被酸性高锰酸钾氧化.
解:(1)烷烃的分子中含有14个氢原子,烷烃的通式为:CnH2n+2,则2n+2=14,所以n=6,即烷烃的分子式为C6H14,为己烷,故答案为:己烷;
(2)烷烃相对分子质量越大,沸点越高,同分异构体中,含支链越多,沸点越低,正丁烷,异丁烷,正戊烷三种物质,按沸点由高到低顺序排列为CH3﹣CH2﹣CH2﹣CH2﹣CH3>CH3CH2CH2CH3>(CH3)2CHCH3,
故答案为:CH3﹣CH2﹣CH2﹣CH2﹣CH3>CH3CH2CH2CH3>(CH3)2CHCH3,
(3)令该烷烃的分子式为CnH2n+2,相对分子质量为72,则14n+2=72,解得n=5,
故该烷烃的分子式为C5H12,C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4,
故答案为:C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4;
(4)有机物完全燃烧生成二氧化碳和水的物质的量之比为2:3,根据C、H原子守恒知,该有机物中C、H原子个数之比=2:6,应为乙烷,结构式为 ,
,
故答案为: ;
;
(5)丙烷为饱和烃,苯性质稳定,与高锰酸钾不反应,乙烯、丁烯含有碳碳双键,可被酸性高锰酸钾氧化,故答案为:CH3CH2CH3和![]() .
.


科目:高中化学 来源: 题型:
【题目】《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。其方法与分离下列物质的实验方法原理上相同的是
A. 甲苯和水 B. 硝酸钾和氯化钠
C. 食盐水和泥沙 D. 乙酸乙酯和甘油(丙三醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2 和Na2S ②Na2O 和 Na2O2 ③CO2和 CS2 ④HCl 和 NaOH
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 单晶硅是石英的主要成分
B. 钠钾合金可用于快中子反应堆的热交换剂
C. 小苏打可用于焙制糕点
D. 水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,F元素的原子最外层电子数是电子层数的二倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X中所含化学键类型有 。(填数字编号)
①离子键 ②极性键 ③非极性键 ④配位键 ⑤氢键
(4)由A、B两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,其水合物是一种二元弱碱,则Y的电子式为 ;由A、C、F三种元素形成的某化合物能与化合物Y形成一种酸式盐,常温下。1mol/L该酸式盐的pH为1,请写出该酸式盐的化学式 。
(5)化合物Y和A、C形成的18电子分子可相互反应生成两种产物,其中一种产物是空气的主要成分,请写出反应的化学方程式: 。
(6)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
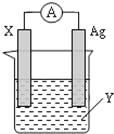
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下单质碘为固体,单质氯为气体。尽管两者存在的状态不同,但两者( )
A. 均含离子键 B. 都含离子键和共价键
C. 均含共价键 D. 均可与H2形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com