
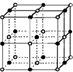
 完成下列问题.
完成下列问题.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
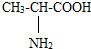 )中碳原子的共价键分析;
)中碳原子的共价键分析;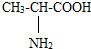 )中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;
)中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;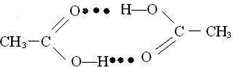 ,
,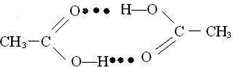 ;
;

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4 |
| B、[H+]=1×10-3mol?L-1 |
| C、[OH-]=1×10-12mol?L-1 |
| D、[OH-]=1×10-14mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉 |
| B、图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2 |
| C、图3表示表示向盐酸和醋酸混合溶液中滴入氨水 |
| D、图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com