
| A. | 电解过程中阴极没有气体生成 | |
| B. | 电解过程中转移的电子的物质的量为0.4 mol | |
| C. | 原CuSO4溶液的浓度为0.1 mol•L-1 | |
| D. | 电解过程中阳极收集到的气体体积为2.24 L(标况下) |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1molH2SO4,并电解了0.1molH2O;
A、根据以上分析,阴极有氢气放出;
B、根据以上分析计算;
C、没有体积无法计算;
D、根据以上分析计算.
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+2CuSO4$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
A、根据以上分析,阴极有氢气放出,故A错误;
B、根据以上分析计算,电解过程中共转移电子为0.4 mol,故B正确;
C、没有体积无法计算,故C错误;
D、根据以上分析,阳极收集到的气体体积为(0.05+0.05)×22.4=2.24L,故D错误;
故选:B.
点评 本题考查电解池的工作原理,先根据出什么加什么判断电解的过程,再根据电解方程式进行计算,难度一般.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都难溶于水,且都是密度比水大的液体 | |
| B. | 所有卤代烃都是通过取代反应制得,且都是良好的有机溶剂 | |
| C. | 煮沸氯乙烷和氢氧化钠的醇溶液能发生消去反应 | |
| D. | 煮沸氯乙烷和氢氧化钠溶液能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{3}$H | B. | 丁烷和异丁烷 | C. | O2和O3 | D. | H2O和H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>D>A>B | C. | D>A>B>C | D. | A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: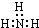 | B. | S2-的结构示意图: | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
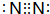 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
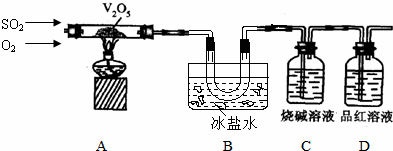
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
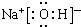 .
.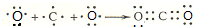
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com