
| A、Cl2是氧化剂,反应中Cl原子得到电子 |
| B、当1molCl2完全反应时,有2mol电子发生转移 |
| C、NaBr是还原剂,反应中溴离子得到电子 |
| D、当1molNaBr完全反应时,有1mol电子发生转移 |


科目:高中化学 来源: 题型:
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A、曲线Ⅱ对应的条件改变是降低压强 |
| B、若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C、反应开始至a点时v(H2)=1mol?L-1?min-1 |
| D、其它条件不变,若降低该反应的温度,平衡常数值将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,46g NO2中含有氧原子个数为2NA |
| B、在标准状况下,22.4 L丙烷中所含C-H键数目为6NA |
| C、将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA |
| D、以二氧化锰和浓盐酸为原料制备氯气,当生成1mol氯气,电子转移总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
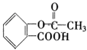 )具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.写出阿司匹林与足量NaOH溶液共热反应的化学方程式:
)具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.写出阿司匹林与足量NaOH溶液共热反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在自然界中既有化合态又有游离态 |
| B、单质常用作半导体材料 |
| C、气态氢化物很稳定 |
| D、最高价氧化物不与任何酸反应,可制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇在空气中燃烧--淡蓝色 |
| B、钠在空气中燃烧--黄色 |
| C、钾在空气中燃烧--绿色 |
| D、氢气在氯气中燃烧--苍白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下浓H2SO4能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| B、Cl2能与石灰乳反应,可用于制取漂白粉 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、石墨具有导电性,可用于制造半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=13的溶液中:K+、Al3+、Cl-、SO42- |
| B、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、由水电离的c(H+)=10-12 mol?L-1的溶液中,K+、Na+、Cl-、SO4 |
| D、室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com