
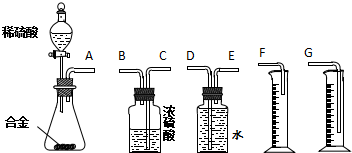
| A. | 步骤①中发生的主要反应为Cl2+2Br-═Br2+2Cl- | |
| B. | 步骤②③的目的是富集溴元素 | |
| C. | 物质X 为HBrO | |
| D. | 空气吹出法用到了溴易挥发的性质 |
科目:高中化学 来源: 题型:选择题
| A. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)═Cu2++2NO3-+2NO2↑+2H2O | |
| B. | 向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 | |
| C. | 标准状况下,2.24L SO3含有分子的数目为0.1NA | |
| D. | 1mol 硫酸氢钠溶液中含有阳离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
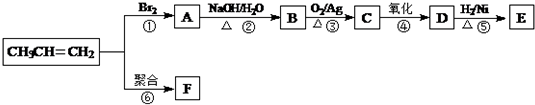
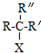 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$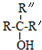 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)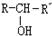 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$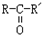 ,
,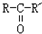 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$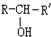
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “洧水”的主要成分是油脂 | B. | “洧水”的主要成分是煤油 | ||
| C. | “洧水”的主要成分是石油 | D. | 其烟的主要成分是石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰用作食品抗氧化剂 | |
| B. | 盐类都可作调味品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 小苏打是面包发酵粉的主要成分之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com