(2011?黄山模拟)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
原子最外层电子数是次外层的三倍 |
| Z |
单质及其化合物的焰色反应为黄色 |
| W |
W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表第
ⅣA
ⅣA
族.X的一种单质熔点很高,硬度很大,则这种单质的晶体属于
原子
原子
晶体.
(2)X与Y中电负性较强的是(填元素符号)
O
O
;XY
2的电子式是
,分子中存在
2
2
个σ键.
(3)Z
2Y
2中含有的化学键类型有
离子键和非极性键
离子键和非极性键
.阴、阳离子的个数比为
1:2
1:2
.
(4)W的基态原子核外电子排布式是
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
.
(5)废旧印刷电路板上有W的单质A.用H
2O
2和H
2SO
4的混合溶液可溶出印刷电路板上的A.已知:
A(s)+H
2SO
4(aq)═ASO
4(aq)+H
2(g)△H=+64.4kJ?mol
-12H
2O
2(l)═2H
2O(l)+O
2(g)△H=-196.4kJ?mol
-1H
2(g)+
O
2(g)═H
2O(l)△H=-285.8kJ?mol
-1请写出A与H
2SO
4、H
2O
2反应生成ASO
4(aq)和H
2O(l)的热化学方程式(A用化学式表示):
Cu (s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O (l)△H=-319.6 kJ/mol
Cu (s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O (l)△H=-319.6 kJ/mol
.

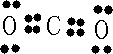
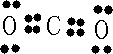
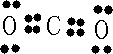 ,分子中含有2个C=C键,其中有2个σ键,
,分子中含有2个C=C键,其中有2个σ键,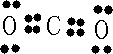 ;2;
;2;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案