
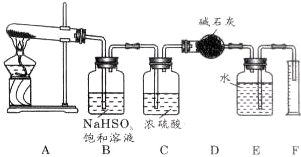
分析 (1)根据混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2;
(2)根据浓硫酸可作干燥剂;根据SO2能与碱石灰反应,而氧气与与碱石灰不反应;
(3)根据氧气不溶于水,可用排水法测定气体的体积;
(4)根据量筒内液体的体积即为O2的体积,根据n=$\frac{v}{vm}$来分析;根据干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的),再根据电子得失守恒n(O2)×4=n(SO2)×2求出分解产生的SO2的物质的量,最后根据方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑求出SO3的物质的量.
解答 解:(1)混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2:SO3+2NaHSO3=Na2SO4+H2O+2SO2↑,可NaHSO3来除去三氧化硫,
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气;SO2能与碱石灰反应,而氧气与与碱石灰不反应,所以干燥管收集到的物质是SO2,
故答案为:干燥SO2和O2;SO2;
(3)因氧气不溶于水,可用排水法测定气体的体积,将由D来的气体将E中的水压到量筒F中,测定生成O2的体积,
故答案为:由D来的气体将E中的水压到量筒F中,测定生成O2的体积;
(4)量筒内液体的体积即为O2的体积,其物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,根据电子得失守恒n(O2)×4=n(SO2)×2,即0.005mol×4=n(SO2)×2,则n(SO2)=0.01mol,干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的)为1.28g,物质的量为0.02mol,所以与NaHSO3反应生成的SO2为0.01mol,由方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑可知SO3的物质的量为0.005mol,
故答案为:O2;0.005;0.01;0.005.
点评 本题主要考查了实验的原理与计算,在计算时要抓住电子得失守恒,尤其要注意干燥管增重的质量为SO2的质量包括原来的和通NaHSO3后生成的,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在烧瓶中装约$\frac{1}{3}$体积的自来水,并放入几粒沸石防暴沸 | |
| B. | 若使用温度计须将温度计水银球插到自来水中 | |
| C. | 冷水从冷凝管下口入,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4、NaOH-腐蚀品 | B. | 酒精-易燃气体 | ||
| C. | KMnO4-氧化剂 | D. | 白磷-易燃固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.8 mol•L-1 | C. | 1.4 mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集中处理废旧电池,以防止重金属污染环境 | |
| B. | 海产品中加入大量甲醛以延长保鲜期 | |
| C. | 食用蔬菜水果可以补充人体所需维生素 | |
| D. | 使用加碘盐,可预防因缺碘引起的甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com