


 �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
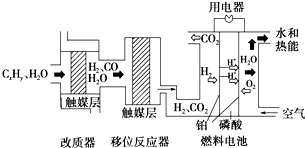 ����ȼ�ϵ����Ŀǰ��Ϊ�����ȼ�ϵ��֮һ���������ɼ���Ӧԭ����ͼ��ʾ������˵������ȷ���ǣ�������
����ȼ�ϵ����Ŀǰ��Ϊ�����ȼ�ϵ��֮һ���������ɼ���Ӧԭ����ͼ��ʾ������˵������ȷ���ǣ�������| A����ϵͳ��ֻ���ڻ�ѧ�ܺ͵��ܵ��ת�� | ||
B������λ��Ӧ���У���ӦCO��g��+H2O��g��
| ||
| C������������λ��Ӧ���������ǽ�CxHyת��ΪH2��CO2 | ||
| D���õ�������ĵ缫��ӦΪO2+4H++4e-=2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
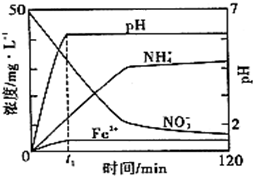 I�����Ρ���������ʵ���ҳ��õ�ҩƷ��
I�����Ρ���������ʵ���ҳ��õ�ҩƷ��| SO | 2- 4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com