
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
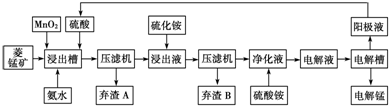
| 3 |
| ||
| ||
| ||


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
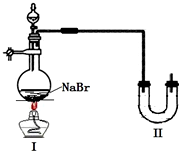 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
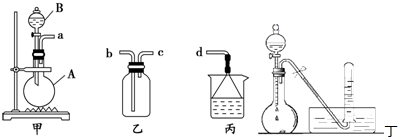
查看答案和解析>>
科目:高中化学 来源: 题型:
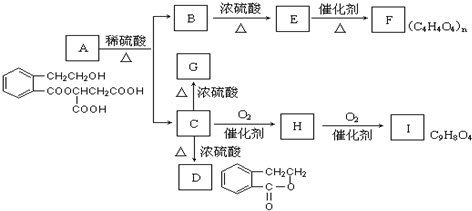
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或预期试验先行 | 现象解释(用离子方程式表示) | ||
| 猜想② | (1) | 溶液PH=8 | --- | |
| 向PH=2的硫酸中滴加Na2S2O3溶液 | (2) | S2O
| ||
| 猜想③ | 向新制氯水(PH<2)中滴加少许Na2S2O3溶液 | 氯水颜色变浅 | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com