
 (一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).
(一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”). .
. 分析 (一)根据戊烷的名称及烷烃通式写分子式,石油分馏是利用各成份的沸点不同进行石油的分馏;
(二)石油裂解可获得A,A在通常状况下是一种相对分子量为28的气体,则A为CH2=CH2,A发生加聚反应生成F为 ,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,据此解答.
,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,据此解答.
解答 解:(一)根据戊烷的名称及烷烃通式可知其分子式为C5H12,石油分馏是利用各成份的沸点不同进行石油的分馏,是物理变化,
故答案为:C5H12;物理;
(二)石油裂解可获得A,A在通常状况下是一种相对分子量为28的气体,则A为CH2=CH2,A发生加聚反应生成F为 ,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,
,A与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,C进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,
(1)由上述分析可知,A为乙烯,分子式为C2H4,乙烯可用于制聚乙烯或乙醇,故答案为:C2H4;用于制聚乙烯或乙醇;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应②是乙醇和乙酸在浓硫酸加热的条件下发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3CH2OH+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应③是乙烯发生加聚反应生成聚乙烯,反应化学方程式为:nCH2=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;加成反应;CH3CH2OH+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;酯化反应;nCH2=CH2$\stackrel{催化剂}{→}$ .
.
点评 本题考查有机物推断,涉及烯、醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →CH≡C-CH═CH2
→CH≡C-CH═CH2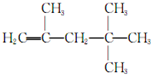 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 可燃性气体的验纯 | ||
| C. | 不能给正燃烧着的酒精灯添加酒精 | D. | 滴管不能交叉使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com