
| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
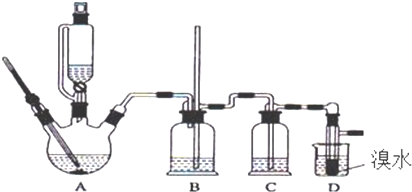
分析 A中乙醇在浓硫酸、加热条件下发生消去反应生成乙烯,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化硫能与溴反应,C装置盛放氢氧化钠溶液除去乙烯中的二氧化碳、二氧化硫,D中乙烯与溴反应生成1,2-二溴乙烷,反应后容器内气压减小,B为安全瓶,可以防止倒吸,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,根据E中内外液面高低变化,可以判断是否发生堵塞,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,D冷却可避免溴的大量挥发,为防止污染空气,D装置之后需要连接盛放氢氧化钠溶液吸收装置;
(1)装置A中乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯,据此写出反应的化学方程式;
(2)装置B为安全瓶,可以防止倒吸;
(3)装置C的作用是除去二氧化碳、二氧化硫等干扰气体,可以用氢氧化钠溶液;
(4)若产物中有少量未反应的Br2,可以用Na2SO3溶液除去,不能利用氢氧化钠溶液,会导致卤代烃发生水解,乙醇与卤代烃互溶,也不能利用乙醇,溴更易溶液有机溶剂,在水中溶解度不大;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)根据1,2-二溴乙烷的凝固点较低(9℃)分析;
(7)D中溴水完全褪色说明反应结束.
解答 解:A中乙醇在浓硫酸、加热条件下发生消去反应生成乙烯,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化硫能与溴反应,C装置盛放氢氧化钠溶液除去乙烯中的二氧化碳、二氧化硫,D中乙烯与溴反应生成1,2-二溴乙烷,反应后容器内气压减小,B为安全瓶,可以防止倒吸,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,根据E中内外液面高低变化,可以判断是否发生堵塞,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,D冷却可避免溴的大量挥发,为防止污染空气,D装置之后需要连接盛放氢氧化钠溶液吸收装置,
(1)A中乙醇发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)乙烯反应后,会导致容器内压强减小,产生倒吸危险,B为安全瓶,可以防止倒吸,
故答案为:平衡压强,作安全瓶,防止倒吸;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,装置C的作用是除去二氧化硫和二氧化碳,根据二氧化碳、二氧化硫能和氢氧化钠溶液反应可知,装置C中加入的试剂可以为氢氧化钠溶液,即d正确,
故选:d;
(4)a.溴更易溶液1,2-二溴乙烷,用水无法除去溴,故a错误;
b.1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,故b错误;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c错误;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d错误,
e.溴与Na2SO3溶液反应离子方程式为:Br2+SO32-+H2O═SO42-+2Br-+2H+,再分液除去,故e正确;
故答案为:e;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,
故答案为:产品熔点低,过度冷却会凝固而堵塞导管口;
(7)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,
故答案为:D中溴水完全褪色.
点评 本题考查制备实验方案的设计,为高频考点,题目难度中等,明确制备实验原理、混合物分离提纯实验等为解答的关键,注意掌握制备方案的设计与评价原则,试题侧重考查学生的分析与实验能力.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫能预测钋在地球上的分布 | B. | 钋在第七周期第ⅥA族 | ||
| C. | 钋的最外层电子数为6 | D. | 钋属于副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核素${\;}_{116}^{297}$Lv的中子数是181 | B. | 红磷和白磷互为同素异形体 | ||
| C. | CH4O和C2H6O互为同系物 | D. | 丁烷(C4H10)具有2种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子188O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | CO2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com