
【题目】将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )
A.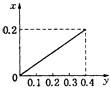
B.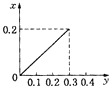
C.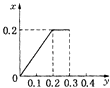
D.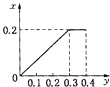
【答案】C
【解析】解:22.4g铁的物质的量为 ![]() =0.4mol,令铁完全反应需硝酸的物质的量为n,则:
=0.4mol,令铁完全反应需硝酸的物质的量为n,则:
Fe+ | 4HNO3(稀)=Fe(NO3)3+NO↑+2H2O |
1 | 4 |
0.4mol | n |
所以n=1.6mol,由于1.6mol>0.8mol,所以Fe有剩余,根据硝酸计算生成NO的物质的量,参加反应生成NO的Fe的物质的量,则:
Fe+ | 4HNO3(稀)=Fe(NO3)3 + | NO↑+2H2O |
1mol | 4 mol | 1mol |
0.2mol | 0.8mol | 0.2mol |
根据生成NO的物质的量,参加反应生成NO的Fe的物质的量作图,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系如图:
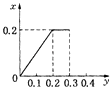
故选:C.
铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,开始硝酸过量,铁与硝酸反应生成硝酸铁、一氧化氮,当硝酸反应完毕后,铁若有剩余,再与硝酸铁反应生成硝酸亚铁.
先判断铁与硝酸反应生成硝酸铁、一氧化氮,铁是否有剩余,若铁有剩余根据硝酸计算生成NO的物质的量,若硝酸有剩余根据铁计算生成NO的物质的量.


科目:高中化学 来源: 题型:
【题目】在一定容积的密闭容器中进行反应;N2(g)+3H2(g)![]() 2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。己知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是
A. N2为0.2mol/L;H2为0.6mol/L B. N2为0.15mol/L
C. N2、H2均为0.18 mol/L D. NH3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)请写出铜的基态原子核外电子排布式:___________。
(2)铜的熔点比钙的高,其原因是____________。
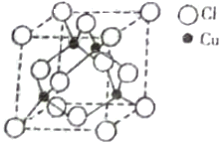
(3)金属铜的堆积方式为下图中的______(填字母序号)。

(4)科学家通过 X 射线推测,胆矾的结构如下图所示。

胆矾的阳离子中心原子的配位数为______,阴离子的空间构型为_______。胆矾中所含元素的电负性从大到小的顺序为_________(用元素符号作答)。
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为______,已知该晶体的密度为 4.14g/cm3,则该晶胞的边长为_______pm(写计算式)。将该物质气化后实验测定其蒸汽的相对分子质量为 198,则其气体的分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s) ![]() MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g) ![]() 2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g) ![]() 2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
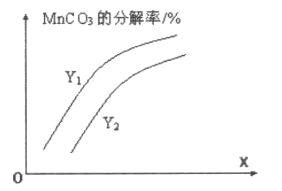
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
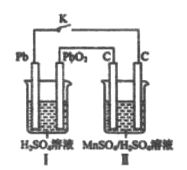
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一一选修修5:有机化学基础】光刻胶是一种应用广泛的光敏材料,它的一种合成路线如下(部分试剂和产物略去):
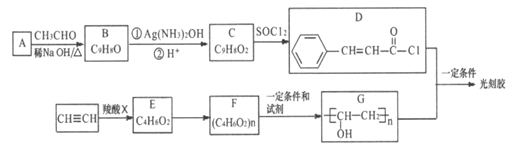
已知:
I.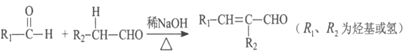
II.![]()
回答下列问题
(1)C中所含官能团的名称是________,G的化学名称为_______________。
(2)乙快和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为_________,E→F的反应类型是___________。
(3)B与Ag(NH3)2OH反应的化学方程式为_________________。
(4)D+G→光刻胶的化学方程式_________________________________。
(5)某芳香族有机物H是C的同系物,相对分子质量比C大14,则该有机物H的苯环上只含有两条侧链的同分异构体有______________种。(不考虑立体异构)
(6)根据已有知识并结合相关信息,写出以CH2CH2OH为原料制备CH2CH2CH2COOH的合成路线流程图(无机试剂任用) ______________________。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类面临的重大威胁,下列对应关系不正确的是( )
环境问题 | 造成环境问题的主要物质 | |
A | 酸雨 | 二氧化硫 |
B | 温室效应 | 二氧化碳 |
C | 白色污染 | 二氧化硅 |
D | 光化学烟雾 | 二氧化氮 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com