
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)△H>0,达到平衡。下列说法不正确的是
CaO(s)+CO2(g)△H>0,达到平衡。下列说法不正确的是
A. 升高反应温度,压强将会增大
B. 增大压强,达新平衡时c(CO2)增大
C. 向平衡体系中加入CaO(s),平衡不移动
D. CaCO3(s)分解生成CaO(s)和CO2(g),△S>0
科目:高中化学 来源: 题型:
【题目】以下三组溶液:①植物油和水 ②氯化钠和单质碘的水溶液 ③40%的乙醇溶液,分离以上混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油分馏得到的各馏分仍是混合物
B.煤的气化、液化、干馏过程中都有化学变化
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.在一定条件下,苯与氢气生成环己烯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)在密闭容器中充入一定量的H2S,发生反应2H2S(g)![]() 2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
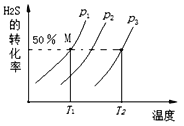
①该反应的ΔH__________0(填“>”、“=”或“<”);
②图中压强(p1、p2、p3)由小到大的顺序为_____________________;
③图中M点的平衡常数KP=_______________(KP是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)羰基硫(COS)是一种粮食熏蒸剂,能有效防止粮食被某些昆虫、线虫和真菌危害。在2 L的密闭容器中,保持温度T不变,将CO和H2S混合,并达下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
①若达平衡时n(H2S)=5mol,a 为_______。平衡时CO的转化率为________。
②曲线Ⅰ和Ⅱ表示该温度下,CO和H2S投料比[n(CO)/ n(H2S)]不同时,CO转化率随时间变化图像。则曲线Ⅰ和Ⅱ中a值的大小关系为:Ⅰ___Ⅱ(填“大于”“等于”“小于”),理由是____。
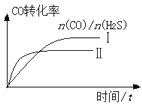
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 溶于水能导电的化合物一定是离子化合物
B. 在共价化合物中一定含有共价键
C. 含有共价键的化合物不一定是共价化合物
D. 离子化合物中不一定都含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯时,正确的操作顺序应该是
A.先加入浓硫酸,再滴加苯,最后滴加浓硝酸
B.先加入苯,再加浓硝酸,最后滴入浓硫酸
C.先加入浓硝酸,再加入浓硫酸,最后滴入苯
D.先加入浓硝酸,再加入苯,最后加入浓硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A. 乙醇汽油可以减少汽车尾气污染
B. 化妆品中添加甘油可以起到保湿作用
C. 有机高分子聚合物不能用于导电材料
D. 葡萄与浸泡过高锰酸钾溶液的硅藻土放在一起可以保鲜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11、 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)醋酸钠溶液中各离子浓度由大到小的顺序为_________________________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)物质的量浓度为0.1 mol/L 的 CH3COONa 溶液和 0.1 mol/LCH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是__________。a.c(Na+)+c(H+)=c(CH3COO—)+c(OH-)
b.c(CH3COO—)+c(CH3COOH)=0.2 mol/L
c.c(CH3COOH)+2c(H+)=c(CH3COO—)+2c(OH—)
(6)若醋酸的起始浓度为1.0 mol/L,平衡时氢离子浓度c(H+)=_______。(已知: ![]() ≈1.4,计算结果保留两位有效数字)
≈1.4,计算结果保留两位有效数字)
(7)常温下,取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定,用pH计采集数据,电脑绘制的滴定曲线如下图所示。当pH =11. 0 时,NH3H2O电离平衡常数Kb≈_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com