
���� A��B��C��D����Ԫ�ص�ԭ���������ε�����A��BԪ�صĻ�̬ԭ��L���Ӳ���ĩ�ɶԵ������ֱ�Ϊ3��2����Aԭ�Ӻ�������Ų�ʽΪ1s22s22p3��AΪ��Ԫ�أ�B��ԭ���������ڵ�Ԫ�أ���Bԭ�Ӻ�������Ų�ʽΪ1s22s22p4��BΪ��Ԫ�أ�����������Ԫ����CԪ�صĵ縺����С����CΪNaԪ�أ�DԪ�ر���Ϊ��������֮��ĵ�����������Ͻ�����ں��칤ҵ������Ϊ��21���͵Ľ����������̬ԭ����Χ����ռ�������ܼ��Ҹ��ܼ���������ȣ���DΪTiԪ�أ����Ԫ���������Լ���ĿҪ������⣮
��� �⣺��1����Ԫ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ���Ͻ�����Խǿ��һ������ԽС�����һ��������С�����˳����Na��O��N���ʴ�Ϊ��Na��O��N��
��2��DΪTiԪ�أ���������Ų�ʽΪ[Ar]3d24s2���ʴ�Ϊ��[Ar]3d24s2��
��3���ð�ɫ����ΪNa3NO4��NO43-������Nԭ�Ӽ۲���Ӷ���=4+$\frac{5+3-2��4}{2}$=4��Nԭ��û�й¶Ե��ӣ�����Ϊ��������ṹ��Nԭ�Ӳ�ȡsp3�ӻ���
�ʴ�Ϊ���������壻sp3��
��4��A2BΪN2O���۵���Ϊ16������3��ԭ�ӣ����Ӧ�ĵȵ�����ΪCO2 ��CS2���ʴ�Ϊ��CO2 ��CS2��
��5��Ti3+����λ����Ϊ6����������Һ�е���AgNO3��Һ����������ɫ��������������������������磬���ݳ�������ϴ�Ӹ�������������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ��������Ϊ��ɫ�����ˮ��Һ��Ӧ�õ�����������$\frac{2}{3}$����֪��ɫ�����к�3�������ӣ���ɫ�����к�2�������ӣ�����ɫ����Ļ�ѧʽΪ[TiCl��H2O��5]Cl2•H2O���������Ӽ������Լ�����λ����
�ʴ�Ϊ��[TiCl��H2O��5]Cl2•H2O��abd��
���� �������ʽṹ�����ʣ�Ϊ�߿��������ͣ���Ŀ�漰��������Ų��������ܡ��ӻ���������ṹ���ȵ����塢�����ȣ��ƶ�Ԫ���ǽ���ؼ���ע�����յȵ�����ĸ��ע����������ڽ�������������ӵ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ���ʣ�4v����O2��=5v����NO�� | |
| B�� | NH3��O2��NO��H2O�ķ��Ӹ�������4��5��4��6 | |
| C�� | ��λʱ��������4 mol NO��ͬʱ����6 mol H2O | |
| D�� | ��Ӧ�������NH3������������ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʱ��/min Ũ��/��mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�
��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | H2��g�� | CO��g�� | CH3OH��l�� |
| ��ȼ���ȣ�25�棩 ��H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
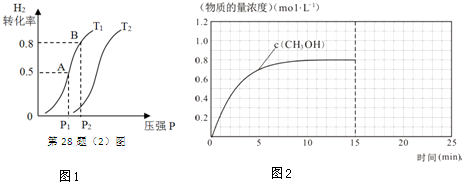
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol H2���6.02��1023��H | B�� | 1 mol������6.02��1023��O2 | ||
| C�� | 1 mol CaCl2��Һ�ﺬ��1 mol���� | D�� | 1 mol H+�к���H+��ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com