
����Ŀ����1���ö��Ե缫���CuSO4��Һ����ͼ��װ�ã���
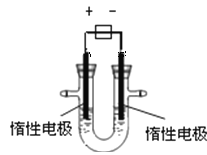
�ù����е��ص缫��ӦʽΪ�������� �� ������ ��
��2����������װ��������Һ������������3.2gʱ��ֹͣͨ�磬��ʱ��������������������״����Ϊ ����������ȫ���ݳ�����
��3����ʹ���Һ�ָ�����ʼ״̬��Ӧ����Һ�м���������
A��CuSO4 B��H2O C��CuO D��CuSO4��5H2O
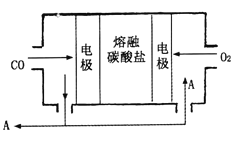
��4����Na2CO3������������ʣ�CO��O2Ϊԭ����ɵ����͵�ص��о�ȡ�����ش�ͻ�ơ��õ��ʾ��ͼ���ң������缫��ӦʽΪ_________________________��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ�����в���A���ʲμ�ѭ����A���ʵĻ�ѧʽΪ__________________��
���𰸡���1��4OH-=O2+2H2O+4e- 2Cu2++4 e- = 2Cu ��2��0.56L
��3��C ��4��CO32-+CO![]() 2CO2+2e�� CO2
2CO2+2e�� CO2
��������
�����������1���ö��Ե缫�������ͭ��Һʱ�����������������ӷŵ����缫��ӦʽΪ��4OH-=O2+2H2O+4e-��������ͭ���ӷŵ����缫��ӦʽΪ��2Cu2++4 e- = 2Cu ��
��2����������3.2g��ӦΪͭ��������ͭ���ʵ���Ϊn=3.2g��64g/mol=0.05 mol��ת�Ƶĵ���Ϊ0.05mol �� 2 = 0.1mol���������缫ת�Ƶĵ�����Ŀ��ȣ�������ת�Ƶĵ���ҲΪ0.1mol�����������������������ʵ���Ϊ0.1mol��4=0.025mol���ų������ڱ�״���µ����Ϊ0.025mol��22.4L/mol=0.56L��
��3������Һ��������������������ͭ����Ϊϡ�����������ͭ������Ӧ����������ͭ��Ӧ��������ͭ��Ӧ��������ͭ����������Һ�м�������ͭ���ɣ���ѡC��
��4����ȼ�ϵ�ص��ܷ�ӦΪ��2CO+O2=2CO2��ͨ��������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2CO2=2CO32-��ͨ��CO��һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CO32-+CO![]() 2CO2+2e�������ݵ缫��Ӧ��֪����������CO2���壬����������CO2���壬���Ե�ع���ʱ�����в��ֶ�����̼�μ�ѭ������A���ʵĻ�ѧʽΪCO2��
2CO2+2e�������ݵ缫��Ӧ��֪����������CO2���壬����������CO2���壬���Ե�ع���ʱ�����в��ֶ�����̼�μ�ѭ������A���ʵĻ�ѧʽΪCO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�������ڱ��е����λ�����±����������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ���������ͬ����Ԫ�أ������ж���ȷ����
A. �������ԭ���������3
B. ��̬�⻯������ȶ��ԣ���>��>��
C. ����������Ԫ���У�������ӵİ뾶���
D. �ҵĵ����ڿ�����ȼ�����ɵĻ�����ֻ�����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ͼ��ʾ��10mLpH=3��A��Һ�м�ˮϡ�͵�V1mL��ҺpH�ı仯������˵������ȷ���ǣ� ��
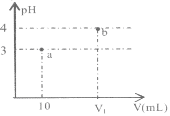
A.��V1=100����ϡ��ǰA��Ũ��һ����0.001mol/L
B.��AΪNH4Cl��HCl�Ļ����Һ����V1һ������100
C.a��ˮ�ĵ���̶�һ��С��b��
D.��AΪNH4Cl��NH3��H2O�Ļ����Һ������Һ��c(NH4+)��c(Cl-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ�Ļ�ѧ����ʽΪ��N2(g)+3H2(g) ![]() 2NH3(g) ������92.3kJ/mol��һ���¶��£������Ϊ2L���ܱ������м���1mol N2��3mol H2����2min��ﵽƽ�⣬ƽ��ʱ���NH3��Ũ��Ϊ0.5 mol/L��
2NH3(g) ������92.3kJ/mol��һ���¶��£������Ϊ2L���ܱ������м���1mol N2��3mol H2����2min��ﵽƽ�⣬ƽ��ʱ���NH3��Ũ��Ϊ0.5 mol/L��
��1��2min ��H2�ķ�Ӧ����v(H2)�� ��
��2����ַ�Ӧ���ﵽƽ��ʱ���ų������� 92.3kJ����������������С������������������
ԭ���� ��
��3������˵����֤����Ӧ�ﵽƽ��״̬�� ��
A����λʱ���ڣ��Ͽ�1mol N��N��ͬʱ�Ͽ�3mol H��H
B����λʱ���ڣ��γ�1mol N��N��ͬʱ�γ�3mol N��H
C����λʱ���ڣ��Ͽ�1mol N��N��ͬʱ�Ͽ�6mol N��H
D����λʱ���ڣ��γ�1mol N��N��ͬʱ�Ͽ�3mol H��H
��4������һ����Ҫ��;�������Ʊ��������ԭ��N2H4����������֪����������ԭ����N2H4��������NO2��ȼ�գ�����N2��ˮ�������������·�Ӧ��
N2(g)+2O2(g)=2NO2(g) ��H1����67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2����534��0kJ/mol
д������ͬ״̬�£���������Ӧ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ���������ε�����A��B��C��D��E��F����Ԫ�أ���֪Bԭ��������������Aԭ�Ӵ�����������3������Dԭ��������������2����Cԭ���ڲ��������������������10����A��B��D����Ԫ�ص�ԭ������������֮��Ϊ13��A��Bԭ������������֮����D��Fԭ������������֮����ȣ�D��E����������Ԫ�ء��ش��������⣺
��1��EԪ�ص����ƣ� ������Ԫ�����ڱ��е�λ���� ��
��2��AB2�Ľṹʽ ��B���⻯����ԭ�Ӹ�����1:1������ĵ���ʽ ��
��3��A��EԪ�ص���ۺ���������Խ�ǿ���� �����ѧʽ��
��4��B��C��D��F����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���� ����Ԫ�ط��ţ������Ӱ뾶��С���� �������ӷ��ţ���
��5��A��B��C����Ԫ�����ԭ�Ӹ�����ΪnA��nB��nC=1��3��2�Ļ����������AB2ͨ��û�������Һ�з�Ӧ�����ӷ���ʽ�� ��
��6��������Ԫ��M��DԪ��λ�ڲ�ͬ���壬���ݶԽ��߹������ijЩ�������ơ���M���������������C������������Ӧ��ˮ������Һ�У�������Ӧ�����ӷ���ʽΪ ��
��7��E��F�γɵĻ�����X�ڸ��������¿��Ա�������ԭ����ҵ�ϳ��ô˷�Ӧ��ȡ�ߴ��ȵĵ���E��д���û�ѧ��Ӧ�ķ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ƻ�ı䷴Ӧ�������Լӿ졢����������ֹ��Ӧ�Ľ��У�ʹ��ѧ��Ӧ����������������������������ߡ����и�ͼ��ʾ�Ĵ�ʩ�У���Ϊ������ѧ��Ӧ���ʵ���( )��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ£�CHCl3���������л��ܼ������������������ڿ������ױ�������ʵ�����п����Ȼ�ԭCCl4���Ʊ��ȷ£�װ��ʾ��ͼ���й��������£�
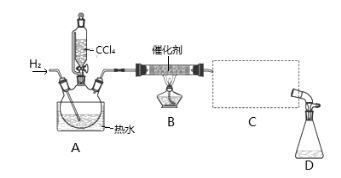
���� | ��Է������� | �ܶ�/(g��mL-1) | �е�/�� | ˮ���ܽ��� |
CHCl3 | 119.5 | 1.50 | 61.3 | ���� |
CCl4 | 154 | 1.59 | 76.7 | ���� |
ʵ�鲽�裺
�ټ���װ�������ԣ��ڿ�ʼͨ��H2�� �۵�ȼB���ƾ��ƣ�
����A��ˮ���м�����ˮ����ͨC������װ�õ���ˮ; ��������ƿ�е���20 mLCCl4��
��Ӧ������ֹͣ���ȣ���D����ƿ���ռ�����Һ��ֱ�������NaHCO3��Һ��ˮϴ�ӣ��ֳ��IJ������������ˮCaCl2���壬���ú���ˣ�
�߶���Һ�����������õ��ȷ�15 g����ش�
��1��������ںͲ���۵�˳��ߵ�����ʵ���в����IJ����������Ϊ ��
��2��B���з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
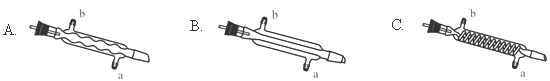
��3��C����Ӧѡ�õ�������Ϊ ����ѡ����ĸ������ˮӦ�Ӹ������ܵ� ���a����b�����ڽ��롣
��4��������У���ˮϴ�ӵ�Ŀ��Ϊ ��
��5����ʵ���У��ȷµIJ���Ϊ ��
��6���ȷ��ڿ������ܱ�������������HCl������COCl2�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2�ֱ�ͨ����CaCl2��Һ����Na2SiO3��Һ����Ca(ClO)2��Һ��������Na2CO3��Һ,�����г����������ǣ� ��
A. �٢ڢۢ� B. �ڢ� C. �٢ڢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�

�������Ҫ��ش�
��1��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�����壻��____________________��
��2����ͬһ�����µ������Ϊ��V��Cl2��/V��CH4����x��������������������Ȼ��⣬��xֵӦ________________________��
��3��Dװ�õ�ʯ���о��Ȼ���KI��ĩ����������________________________________��
��4����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ________________________________________��
��5��Eװ�ó����������⣬�������л����E�з�����л������ѷ���Ϊ________����װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ________����������
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com