
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
|
|
甲 |
|
|
|
|
|
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
C
【解析】
试题分析:甲、乙、丙、丁为四种短周期元素,由甲与乙、丙、丁在周期表中的位置关系可知,甲位于第二周期,原子序数:乙>丙,且丁的原子序数与乙、丙原子序数之和相等,故甲与丁处于同主族,甲与乙、丙处于同一周期,乙在甲的右侧相邻、丙在甲的左侧相邻,令甲的原子序数为x,则乙为x+1、丙为x-1,丁为x+8,则x-1+x+1=x+8,解得x=8,故甲为O、乙为F、丙为N、丁为S。A、非金属性F>O,非金属性越强氢化物越稳定,故氢化物稳定性HF>H2O,故A错误;B、丁为S,在周期表中的位置为第3周期ⅥA族,故B错误;C、硝酸、硫酸都属于强酸,故C正确;D、电子层结构相同核电荷数越大离子半径越小,则离子半径N3->O2->F-,最外层电子数相同电子层越多离子半径越大,则离子半径S2->N3-,故离子半径S2->N3->O2->F-,故错误。
考点:元素周期律和元素周期表的综合应用


科目:高中化学 来源: 题型:
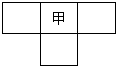 甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )| A、元素甲的简单气态氢化物稳定性比乙的强 | B、元素乙在周期表中的位置为第2周期,VIA族 | C、元素丙和元素丁的最高价氧化物对应的水化物均为强酸 | D、4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲(g)的能量一定大于丙(g)的能量 | B、该反应不需要加热 | C、1 mol甲(g)与2 mol乙(g)的总能量高于1 mol丙(g)和1 mol丁(g)的总能量 | D、该反应表示:1 mol甲(g)与2 mol乙(g)在一定条件下反应放出的热量为a kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
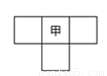
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素丁在周期表中的位置为第3周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
查看答案和解析>>
科目:高中化学 来源:期中题 题型:推断题
 X ,甲 + 丁
X ,甲 + 丁 Y,丙 + 乙
Y,丙 + 乙 Z ,丁 + 乙
Z ,丁 + 乙 W
W  X :___________________
X :___________________ Y:___________________
Y:___________________ Z :___________________
Z :___________________ W:___________________
W:___________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com