


科目:高中化学 来源: 题型:
| A、钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B、纯铁比生铁的耐腐蚀性强 |
| C、铝是比较活泼金属,不能用铝制容器盛放冷的浓硫酸 |
| D、将铜放入稀硫酸中不溶解,再加入一些硝酸钾溶液铜就可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
. |
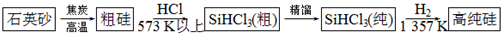
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=0.3 |
| B、x<0.3 |
| C、0.3<x<0.6 |
| D、以上结论都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeS和CuS |
| B、FeS |
| C、CuS |
| D、Al2S3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com