
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
分析 根据元素周期律可知,元素的性质随原子序数的递增而呈现周期性的变化,而这种变化是由原子的电子排布的周期性变化引起的来解答.
解答 解:A.因结构决定性质,相对原子质量的递增与元素性质的变化没有必然的联系,故A错误;
B.由原子的电子排布可知,随原子序数的递增,原子结构中电子层数和最外层电子数呈现周期性变化,则元素原子的核外电子排布的周期性变化是元素的性质呈周期性变化的根本原因,故B正确;
C.因元素的金属性和非金属性都是元素的性质,则不能解释元素性质的周期性变化,故C错误;
D.元素的原子半径的变化属于元素的性质,不能解释元素性质的周期性变化,故D错误;
故选B.
点评 本题考查元素性质周期性变化的原因,为高频考点,明确结构与性质的关系是解答的关键,并应熟悉常见的元素的性质来解答,题目难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 1mol冰中有2mol氢键 | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 1molH3O+含有11mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
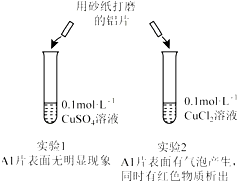
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| B. | 原子半径Na>Mg>Al | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
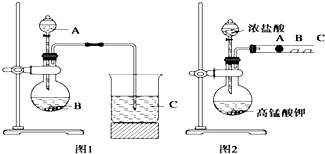 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钾溶液 | B. | 纯碱溶液 | C. | 碳酸氢钙溶液 | D. | 小苏打溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com