

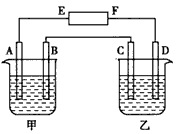
已知:通电一段时间后,C极上出现大量的红色铜单质。
1.电池的正极是_________(填“A”或“B”);
2.D电极的名称叫_________(填“正”“负”“阴”或“阳”),其电极反应式为:__________________;
3.乙装置的名称叫_________池(填“原电”或“电解”);检验F极上产生的气体的方法为__________________。装置中总反应的化学方程式为__________________。若向溶液中滴人酚酞试液,在_________极(填“E或“F”)显红色。
4.如果通电过程中若有0.4mol电子通过,则C极中析出铜的质量为_________;D极上产生的气体体积为_________(设为标准状况下)。
5.如果将甲改装成铜的电解精炼装置,则粗钢板应作_____极(填“C”或“D”),粗铜电极上的电极反应(主要的)_________。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:全优设计必修二化学苏教版 苏教版 题型:022
在下图中,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则:

(1)电源E为________极,F为________极.
(2)A极的电极反应式为________,析出物质________mol.
(3)B极的电极反应式为________,析出气体________mL(标准状况).
(4)C极的电极反应式为________,析出物质________mol.
(5)D极的电极反应式为________,析出气体________mL(标准状况).
(6)甲烧杯中滴入石蕊试液,________附近变红,如果继续电解,在甲烧杯中最终得到________溶液.
查看答案和解析>>
科目:高中化学 来源:必修二全优指导化学苏教版 苏教版 题型:022
在下图中,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则:

(1)电源E为________极,F为________极.
(2)A极的电极反应式为________,析出物质________mol.
(3)B极的电极反应式为________,析出气体________mL(标准状况).
(4)C极的电极反应式为________,析出物质________mol.
(5)D极的电极反应式为________,析出气体________mL(标准状况).
(6)甲烧杯中滴入石蕊试液,________附近变红,如果继续电解,在甲烧杯中最终得到________溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)电源E为__________极,F为__________极。
(2)A极的电极反应式为_______________________,析出物质__________mol。
(3)B极的电极反应式为_______________________,析出气体__________mL(标准状况)。
(4)C极的电极反应式为_______________________,析出物质__________mol。
(5)D极的电极反应式为_______________________,析出气体__________mL(标准状况)。
(6)甲烧杯中滴入石蕊试液,__________附近变红,如果继续电解,在甲烧杯中最终得到__________溶液。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com