
【题目】下列过程中不属于氮的固定的是( )
A.工业合成氨
B.雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐
C.用氨气与硝酸制成“硝铵”化肥
D.豆科作物的根瘤菌将空气中的氮转化为氨
 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
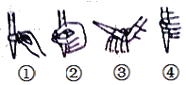
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)
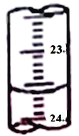
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。
(4)根据下列数据:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 24.10 |
第二次 | 20.00 | 3.00 | 27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
移取10.00 mL密度为ρ g/mL的过氧化氢原溶液稀释成250 mL。量取稀过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(1)用高锰酸钾法(一种氧化还原滴定法)可测定待测液中的H2O2的含量。若需配制浓度为0.10 mol·L1的KMnO4标准溶液500 mL,应准确称取_________g KMnO4[已知M(KMnO4)=158.0 g·mol1]。
a.配制该标准溶液时,下列仪器中不必要用到的有_________。(用编号表示)。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
b.定容时仰视读数,导致最终结果__________(填“偏大”“偏小”或“不变”)。
(2)完成并配平离子方程式:
![]()
![]() +
+![]() H2O2+
H2O2+![]()
![]()
![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________________________。
(4)重复滴定三次,平均耗用KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果______________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
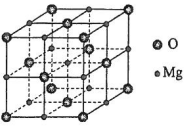
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
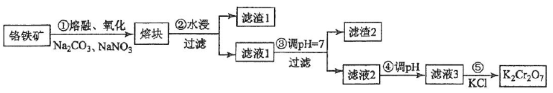
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是_________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________________(填标号)得到的K2Cr2O7固体产品最多。
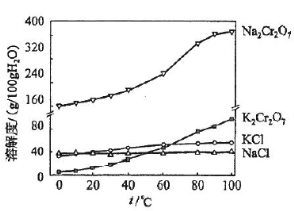
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏B.萃取C.干馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)相同质量的SO2、SO3的氧原子的个数之比为___________。
(3)1/28 mol N2含有a个N原子,则阿伏加德罗常数可以表示为___________mol-1。
(4)4.6g Na单质变成Na+,会失去__________mol的电子
(5)已知VmL的Fe2(SO4)3溶液中含SO42- a g,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅰ]NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
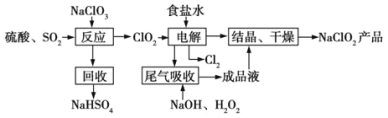
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为___________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com