

���� ��1���軯������ˮ������軯�⣻
��2���軯����˫��ˮ��Ӧ���ɰ�����̼�����ƣ�
��3���軯�������������ƻ������������巢����ը������Ϊ������̼�͵�������������غ���д��ѧ����ʽ��
��4����CN-��ˮ������ҺpH����NaClO��Һ������CN-���ӷ�Ӧ����CNO-�ķ�ˮ����Cr2O72-�ķ�ˮ������ҺpH����Na2S2O3����������ԭ��Ӧ�õ�����������ӵķ�ˮ���ͺ�CNO-�ķ�ˮ���������õ�����ˮ����
��������������֪��������ˮ��������Ҫʹ�õķ�����������ԭ��Ӧ��
�ڼ��������£�CN-������NaClO����������ԭ��Ӧ����CNO-��Cl-���ӣ�
������ÿ0.4molCr2O72-ת��2.4mol�ĵ��������㱻��ԭ��CrԪ�صĻ��ϼۣ�����д���ӷ���ʽ��
�ܸ���������ԭ��Ӧ�е�ʧ��������ȣ��ٽ��ԭ���غ���м��㣮
��� �⣺��1���軯������ˮ������軯�⣬����ʽΪCN-+H2O?HCN+OH-��
�ʴ�Ϊ��CN-+H2O?HCN+OH-��
��2���軯����˫��ˮ��Ӧ���ɰ�����̼�����ƣ�����ʽΪNaCN+H2O2+H2O�TNaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O�TNaHCO3+NH3����
��3���軯�������������ƻ������������巢����ը������Ϊ������̼�͵�������Ӧ�ķ���ʽΪ3NaCN+5NaNO2=3CO2��+4N2��+4Na2O��
�ʴ�Ϊ��3NaCN+5NaNO2=3CO2��+4N2��+4Na2O��
��4�����̷�����CN-��ˮ������ҺPH����NaClO��Һ������CN-���ӷ�Ӧ����CNO-�ķ�ˮ����Cr2O72-�ķ�ˮ������ҺPH����Na2S2O3����������ԭ��Ӧ�õ�����������ӵķ�ˮ���ͺ�CNO-�ķ�ˮ���������õ�����ˮ����
�ٴ����̿���CN-ת��ΪCNO-�����ϼ����߱�������������Cr2O72-ת��ΪCr3+���ϼ۽��ͣ��ʻ�ԭ����ԭ���ʲ��÷���Ϊ����-��ԭ����
�ʴ�Ϊ��D��
�ڲ�����У�������ų���CN-��ClO-����ΪCNO-������Ϊ���ڼ��Ի����У���ClO-ֻ�ܱ���ԭΪCl-����ӦʽΪ��CN-+ClO-�TCNO-+Cl-��
�ʴ�Ϊ��CN-+ClO-�TCNO-+Cl-��
��ÿ0.4molCr2O72-ת��2.4mol�ĵ��ӣ��軹ԭ��CrԪ�صĻ��ϼ�Ϊx����0.4mol��2����6-x��=2.4mol�����x=+3�������ӷ�ӦΪ3S2O32-+4Cr2O72-+26H+�T6SO42-+8Cr3++13H2O��
�ʴ�Ϊ��3S2O32-+4Cr2O72-+26H+�T6SO42-+8Cr3++13H2O��
�ܴ���1mol Cr2O72-�������a mol FeSO4•7H2O�����ݸ�ԭ���غ�ã�1mol Cr2O72-��ȫ��Ӧ������ $\frac{2}{2-x}$mol Fe��[Fex��Cr��2-x����]O4��������ԭ���غ��amol=$\frac{2��1+x��}{2-x}$mol�٣��÷�Ӧ�е�ʧ��������ȣ�1mol��2��3=$\frac{2}{2-x}$mol����3-2����x�����x=1.5����x=1.5����ٵ�a=10��
�ʴ�Ϊ��D��
���� ���⿼�黯ѧ�������̡�����Ϣ��ȡ��Ǩ��Ӧ�á�������ԭ��Ӧ����ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��4���е�������ԭ��Ӧ�ļ���Ϊ�״��㣬��Ŀ�Ѷ��еȣ���������������ѧ���ķ�����������������ѧ����������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢ٢� | B�� | �ڢ٢� | C�� | �٢ڢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
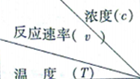 | 1.200 | 1.000 | 0.800 | 0.600 |
| 270 | 3.60 | 3.00 | 2.40 | 1.80 |
| 280 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A�� | �����¶Ȼ�����A��Ũ�ȶ���������v��ֵ | |
| B�� | ͬʱ�ı䷴Ӧ�¶Ⱥ�A��Ũ�ȣ�v���ܲ��� | |
| C�� | a=6.00 | |
| D�� | 270��b��280 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��0-50min֮�䣬pH=2��pH=7ʱR�Ľ���ٷ��ʲ���� | |
| B�� | ��Һ����Խǿ��R�Ľ�������ԽС | |
| C�� | R����ʼŨ�Ⱥ���Һ��pH��Ӱ��R�Ľ������� | |
| D�� | �� 20-25min֮�䣬pH=10 ʱR��ƽ����������Ϊ 0.04mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
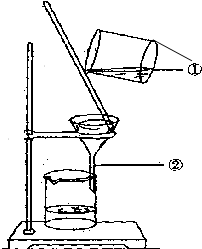 ��ͼΪijѧ�����д����ᴿʵ���й��˲�����ʾ��ͼ���Իش�
��ͼΪijѧ�����д����ᴿʵ���й��˲�����ʾ��ͼ���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ȷ��ȡ0.4000 g NaOH��������100 mL 0.1000 mol•L-1��NaOH����Һ | |
| B�� | �������Լӿ컯ѧ��Ӧ���ʵ����ܸı仯ѧ��Ӧ���ʱ� | |
| C�� | 100 mL pH=3��HA��HB�ֱ���������п��Ӧ��HB�ų��������࣬˵��HB���Ա�HA�� | |
| D�� | ���ڷ�Ӧ2SO2��g��+O2��g��?2SO3��g����ѹ���������ʹѹǿ���������������䣩����SO2��ת��������ƽ�ⳣ��KҲ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com