
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
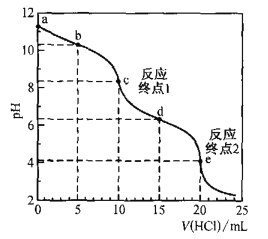
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
【答案】C
【解析】
A. 当加入10mL盐酸时,达到反应终点1,发生了反应:Na2CO3+HCl=NaHCO3+NaCl,即恰好生成了NaHCO3,n(Na2CO3)=n(HCl)=0.01L×0. 100 mol·L—1=0.001mol,所以a点溶液中c(Na2CO3)=![]() =0.020 mol·L—1,正确;
=0.020 mol·L—1,正确;
B. b点加入5mL盐酸,此时溶液中的溶质为等物质的量浓度的Na2CO3、NaHCO3和NaCl,c(Na+)最大,CO32-水解程度大于HCO3-,所以溶液中c(Na+)>c(HCO3— )>c(CO32—),正确;
C. c点溶液中有电荷守恒:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)+c(Cl—),错误;
D. e点时,溶液中溶质为NaCl和H2CO3,根据碳守恒,c(H2CO3)=![]() =
=![]() mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=
mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=![]() =
= =7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
=7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
故选C。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】对Na2C2O4溶液进行研究,下列说法不正确的是(室温下0.1mol· L—1H2C2O4的pH=1.3)
A.Na2C2O4溶液中离子关系:c(C2O42-)+ c(HC2O4-)+ c(H2C2O4) = c (Na+)
B.向Na2C2O4溶液中加入酚酞,溶液变红:C2O42-+H2O![]() HC2O4-+OH-
HC2O4-+OH-
C.向Na2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4 -+ 5C2O42-+16 H += 2Mn 2+ +10CO2↑+8 H2O
D.向Na2C2O4溶液中加入足量稀硫酸制备草酸:C2O42-+2H+= H2 C2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。
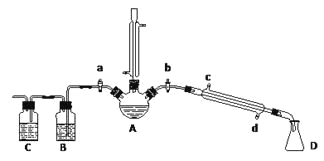
(一)溴乙烷的制备及产物的检验:设计了如上图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
(1)仪器A的名称是_________
(2)制备操作中,加入少量的水,其目的是_______。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是_______、_________
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。请你对该同学的观点进行评价:________________
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用右图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:

Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
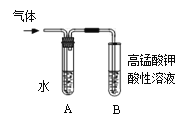
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是______________,若无A试管,B试管中的试剂应为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:
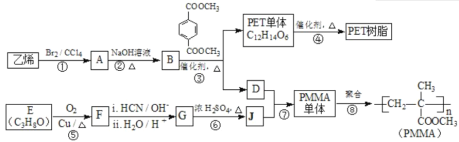
已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ.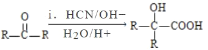 (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol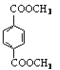 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测
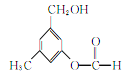
①可以使酸性高锰酸钾溶液褪色
②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应
⑥遇FeCl3溶液可以发生显色反应
其中正确的是( )
A. ①②③⑥ B. ①②③⑤ C. ①②③④ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL-1(NH4)2SO4溶液中逐滴加入0.2000molL-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
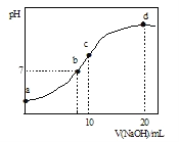
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
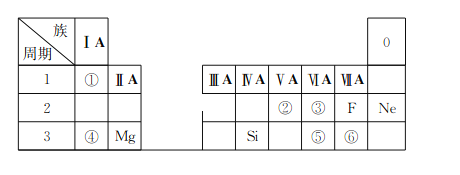
(1)①表示的元素是__________(填元素符号);
(2)②、③两种元素相比较,原子半径较小的是__________(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式__________;
(4)③和⑤两种元素的非金属性强弱顺序是③______(填“<”或“>”)⑤;
(5)④和⑥形成化合物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),表明此反应不一定达平衡的是( )
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com