
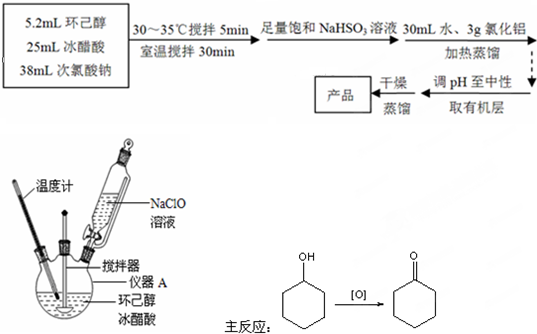
分析 本题是探究运用次氯酸钠氧化环己醇制备环己酮的实验流程,解题时要关注环己酮的物理性质,涉及制备与分离提纯,其中反应在三颈烧瓶中进行,此反应是放热反应,可通过冰水浴及控制反应物的用量等措施来控制温度,反应后的混合物分离时先用饱和NaHSO3溶液除去过量的次氯酸钠,再通过连续二次蒸馏对混合物进行分离提纯,得到较纯净的目标产物;
(1)根据实验装置图及常见的仪器分析;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,利用饱和NaHSO3溶液可除去过量的次氯酸钠;
(4)①液体混合物加热时通常加沸石防暴沸,如果忘记一定要待反应液冷却后再添加;
②分馏得到的液体显酸性,调整到中性,应添加碱性溶液;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶,或借鉴盐析的原理进行分离.
解答 解:(1)由实验装置图可知,图2中仪器A的名称是三颈烧瓶,故答案为:三颈烧瓶;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,同时通过控制反应物的用量,来控制反应速率,因此要缓慢滴加NaClO溶液,故答案为:搅拌器搅拌;缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-,故答案为:ClO-+HSO3-═Cl-+H++SO42-;
(4)①A.实验室可用碎瓷片等代替沸石,正确;
B.如果忘加沸石,应停止加热,待冷却后再添加,错误;
C.当重新进行蒸馏时,用过的沸石不可继续使用,否则会引入杂质,错误;
D.沸石能防暴沸是因为为多孔性物质,可使液体平稳地沸腾,正确;
故答案为:AD;
②无水碳酸钠的溶液和氢氧化钠溶液都显碱性,可中和酸性溶液到中性,故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,静置后会分层,可用分液漏斗分离,所以选择的仪器为分液漏斗,故答案为:降低环己酮的溶解度,有利于环己酮分层;分液漏斗.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
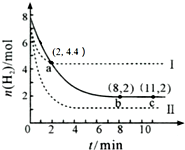
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com