
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中提纯 Al2O3,并回收铁红。流程如下:
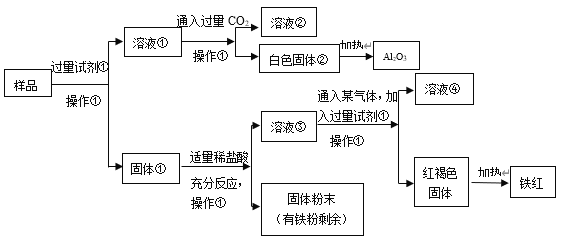
(1)操作①是________________,在实验室进行该操作需要的玻璃仪器有_____________________。
(2)试剂①是________________,该反应的离子方程式是__________________________________。
(3)固体①加入适量稀盐酸,可能发生的反应有:_________________________________(用离子方程式表达)。
(4)溶液③中铁元素的存在形式是___________________,如何用实验证明:_________________。
【答案】过滤 烧杯、漏斗、玻璃棒 NaOH溶液 Al2O3+2OH-=2AlO2-+H2O Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+ Fe2+ 取少量溶液,加入1滴KSCN溶液不显红色,再加入氯水,溶液变红,说明溶液中铁元素以Fe2+形式存在
【解析】
可以发现杂质均不和碱反应,因此过量试剂①是烧碱溶液,将氧化铝全部转化为![]() ,过滤后得到的溶液①即为偏铝酸钠溶液,偏铝酸钠溶液中通入过量
,过滤后得到的溶液①即为偏铝酸钠溶液,偏铝酸钠溶液中通入过量![]() 可以得到
可以得到![]() 白色固体和碳酸氢钠溶液,再加热使
白色固体和碳酸氢钠溶液,再加热使![]() 分解即可得到氧化铝;下面的固体①是铜、铁、氧化铁的混合物,加适量稀盐酸后过滤,得到溶液③,既然固体中有铁粉剩余,则证明铁过量,铁过量的情况下溶液中不可能存在
分解即可得到氧化铝;下面的固体①是铜、铁、氧化铁的混合物,加适量稀盐酸后过滤,得到溶液③,既然固体中有铁粉剩余,则证明铁过量,铁过量的情况下溶液中不可能存在![]() ,也就是说溶液③为
,也就是说溶液③为![]() 溶液,再加入过量的烧碱,得到氯化钠溶液和
溶液,再加入过量的烧碱,得到氯化钠溶液和![]() 红褐色固体,加热使
红褐色固体,加热使![]() 分解得到铁红,本题得解。
分解得到铁红,本题得解。
(1)操作①是过滤,过滤需要的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)根据分析,试剂①是烧碱溶液,反应①是氧化铝溶于烧碱溶液:![]() ;
;
(3)根据分析,固体①的成分必定有铜、铁,可能会有氧化铁,因此加入盐酸后可能会发生![]() 、
、![]() 、
、![]() ;
;
(4)根据分析,溶液③中只有![]() ,若要证明
,若要证明![]() ,可以取少量溶液,加入1滴
,可以取少量溶液,加入1滴![]() 溶液不显红色,再加入氯水,若溶液变红,即可证明
溶液不显红色,再加入氯水,若溶液变红,即可证明![]() 的存在。
的存在。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】用一定浓度盐酸滴定氨水。滴定过程中溶液的pH和导电能力的变化分别如图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法不正确的是( )
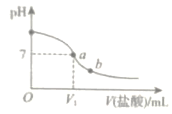
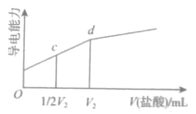
A.a点对应的溶液中:![]()
B.a→b过程中,![]() 越来越小
越来越小
C.c点对应的溶液中![]()
D.根据溶液pH和导电能力的变化可判断:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列实验现象,所得结论不正确的是
实验 | 实验现象 |
| ①品红溶液红色褪去,经检验溶液中含有SO42- ②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。 |
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
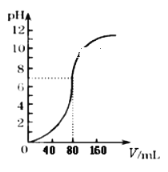
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
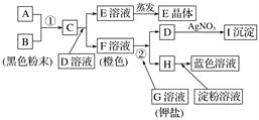
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25℃
B.![]() 的电离方程式为NaHSO4=Na++H++SO42-
的电离方程式为NaHSO4=Na++H++SO42-
C.加入NaHSO4晶体抑制了水的电离
D.由水电离出来的H+的浓度为1×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液可用于浸取硫铁矿中的铁,浸取时发生复杂的氧化还原反应,反应体系中除![]() 和
和![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 和
和![]() ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )
A.氧化剂为![]() 和
和![]()
B.反应后溶液的pH降低
C.每转移2 mol电子消耗3 mol ![]()
D.被氧化的![]() 只占总量的30%
只占总量的30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。

(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。

则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是

A.操作①、④均为过滤
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com