
【题目】![]() U是重要的核工业原料,它的浓缩一直被国际社会关注,有关
U是重要的核工业原料,它的浓缩一直被国际社会关注,有关 ![]() U说法正确的是( )
U说法正确的是( )
A.![]() U原子核中含有92个中子
U原子核中含有92个中子
B.![]() U原子核外有143个电子
U原子核外有143个电子
C.![]() 和
和 ![]() U互为同位素
U互为同位素
D.![]() U和
U和 ![]() U为同一核素
U为同一核素
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A. K+、MnO4-、Cl-、SO42-
B. Na+、CO32-、SO42-、Cl-
C. NO3-、Na+、HCO3-、Ba2+
D. Na+、NO3-、H+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥500mL容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现有质量分数为98%、密度为1.84gcm﹣3 的浓硫酸,该浓硫酸的浓度为mol/L.若需要配制500mL 1molL硫酸溶液,需用98%的浓硫酸mL.
(2)定容时加蒸馏水至距刻线处改用加水使溶液的凹液面正好与刻线相平.
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填写“偏高”“偏低”或“无影响”) ①用以稀释硫酸的烧杯未洗涤
②未经冷却趁热将溶液注入容量瓶
③容量瓶中原有少量的蒸馏水
④定容时观察液面俯视 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烷烃的混合物在标准状况下的密度是1.34 g/L,则关于此混合物组成的说法正确的是( )
A. 可能是甲烷和己烷的混合物 B. 一定有甲烷
C. 可能是乙烷和丙烷的混合物 D. 一定有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺(H2C=CH—CONH2)具有致癌性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120 ℃以上)过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。
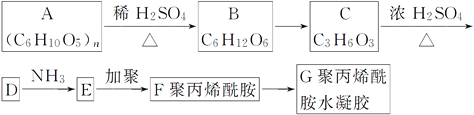
回答下列问题:
(1)D的结构简式为______________;F的结构简式为______________。
(2)指明下列反应类型:A→B____________________,C→D______________________。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:______________________。
(4)写出化学方程式D→E:__________________________________________。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
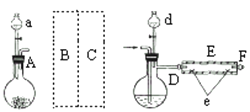
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中能得到Fe2O3 的是( )
A.铁丝在纯氧中燃烧B.红热的铁和水蒸气反应
C.将Fe2(SO4)3 溶液蒸干后灼烧D.加热氢氧化铁固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com