
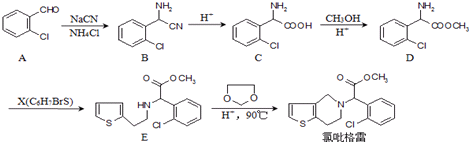
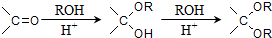
 的合成路线流程图(无机试剂任选).合成路线流程示意图为:
的合成路线流程图(无机试剂任选).合成路线流程示意图为:
 ;
;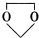 .
. ,故答案为:
,故答案为: ;
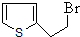
; ,该反应方程式为:
,该反应方程式为: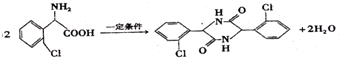 ,故答案为:
,故答案为: ;
;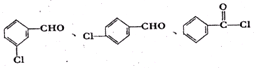 ,故答案为:
,故答案为: ;
; ,合成路线流程图为:
,合成路线流程图为: ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA |
| B、2.3g甲苯和丙三醇的混合物中,含氢原子数目为0.2NA |
| C、1 mol C3H8 分子中含有共价键的数目为 10 NA |
| D、标准状况下,11.2 L的乙烯中含有的共用电子对数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,针对所给的10种元素,回答下列问题.
下表是元素周期表的一部分,针对所给的10种元素,回答下列问题.| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
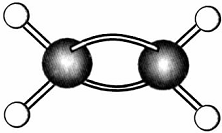
 代表氢原子,
代表氢原子, 代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=
代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、Fe3+、K+、SO42-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com