
【题目】(1)已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1;S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1;Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):①WO2(s)+2H2(g)![]() W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)
W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)![]() W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W
W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W![]() O2(g)的ΔH=______________
O2(g)的ΔH=______________
【答案】MnO2(s)+ SO2 (g)===MnSO4(s) ΔH=-248 kJ·mol-1 +203.9 kJ·mol-1
【解析】
根据盖斯定律分析作答。
(1)将热化学方程式编号为
Mn(s)+O2(g)=MnO2(g) △H=-520 kJ/mol ①;
S(s)+O2(g)=SO2(g) △H=-297 kJ/mol ②;
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065 kJ/mol ③;
根据盖斯定律,将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s) △H=-1065 kJ/mol-(-297 kJ/mol)-(-520 kJ/mol)= -248 kJ/mol;
故答案为:MnO2(s)+ SO2 (g)===MnSO4(s) ΔH=-248 kJ·mol-1
(2)根据盖斯定律,①-②得WO2(s)WO2(g),故该反应的△H=△H1-△H2 = +203.9kJ·mol-1。
故答案为:+203.9 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如下:

已知:
回答下列问题:
(1)A中官能团的名称是______。F的化学名称是______。
(2)C和D生成E的化学方程式为_____________。
(3)G的结构简式为________。
(4)由D生成F,E和H生成J的反应类型分别是______、_____。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有____种,其中核磁共振氢谱有四组峰的结构简式为______(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.与28gCO具有相同分子数的CO2的质量一定是44g
B.与VLCO具有相同分子数的CO2的体积一定是VL
C.所含分子数相等的CO与CO2的密度之比为1∶1
D.所含原子数相等的CO与CO2的密度之比为21∶22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol;
(2)该气体所含原子总数为_________个;
(3)该气体在标准状况下的体积为_________L;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
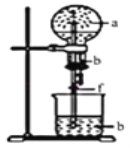
A.a是Cl2,b是饱和NaCl溶液
B.a是NO,b是H2O
C.a是HCl,b是H2O溶液
D.a是CO2,b是饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是____;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是____。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____,其反应的离子方程式为____。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
Ⅱ.乳酸亚铁的制各及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 ___。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液____,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为____%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是

A. 锂离子导电膜应有保护成品电池安全性的作用
B. 该电池工作过程中Fe元素化合价没有发生变化
C. 放电时,负极材料上的反应为6C+xLi++ xe- =LixC6
D. 放电时,正极材料上的反应为LiFePO4 - xe- = Li1-xFePO4 + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示

(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素(Carbon group)包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)六种。
(1)已知Sn为50号元素,其价电子排布式为 ______;价电子中成对电子数为______个。
(2)已知CO与N2的结构相似,则CO的电子式为______,C、O、N第一电离能由大到小的顺序为______,三者最简单氢化物的熔沸点高低顺序为 ______(用“化学式”表示)。
(3)甲硅烷(SiH4)可用来制取超纯半导体硅,工业上采用Mg2Si和NH4Cl在液氨介质中反应制得甲硅烷,该反应的化学方程式为___________。
(4)碳酸氢钠的溶解度小于碳酸钠,是由于HCO3-能够形成双聚或多聚链状离子的结果,HCO3-中C原子的杂化方式为_______,HCO3-能够双聚或多聚的原因是__________。
(5) SiC作为C和Si唯一稳定的化合物,每个Si(或C)原子与周边包围的C(Si)原子通过________杂化相互结合。已经发现SiC具有250多种型体。某立方系晶体其晶胞参数为apm,阿伏加德罗常数的值为NA,该晶胞中原子的坐标参数为:
C部分原子:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
Si全部原子:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() )
)
该立方晶胞中Si原子构成的空间构型为_______,晶体的密度可表示为________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com