
【题目】利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图所示。
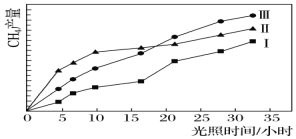
(1)在0~30小时内,CH4的平均生成速率vⅠ、vⅡ、vⅢ从大到小的顺序为__________;反应开始后的12小时内,在第________种催化剂作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1。
①在下列坐标图中,画出反应过程中体系能量变化图(进行必要标注)。________;

②将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,某温度下反应达平衡,平衡常数K=27,此时测得CO的物质的量为0.10 mol,则CH4的平衡转化率为________(结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2生成CO的热化学方程式:_____________。
【答案】vⅢ>vⅡ>vⅠ Ⅱ 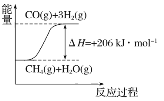 91% CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1 008 kJ·mol-1
91% CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1 008 kJ·mol-1
【解析】
(1)根据图像分析解答;
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应物能量低于生成物能量;根据能量变化画出图象;
CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应物能量低于生成物能量;根据能量变化画出图象;
(3)根据三行式法计算得到转化率;
(4)根据盖斯定律计算。
(1)由图可以知道,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);由图可以知道反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;答案:vⅢ>vⅡ>vⅠ;Ⅱ
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应过程中体系的能量变化图为:
CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应过程中体系的能量变化图为: ;
;
答案: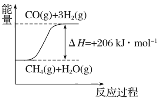
(3)将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数k=27,此时测得CO的物质的量为0.10mol,根据平衡的三步计算可求CH4的平衡转化率。
CH4(g) + H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始量(mol) x x 0 0
变化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x-0.10 x-0.10 0.10 0.30
K=![]() =
=![]() =27
=27
计算得到x=0.11mol
甲烷的转化率=![]() ×100%≈91%;
×100%≈91%;
答案:91%
(4)CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1 ①
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1 ②
根据盖斯定律①-②得到:CO2(/span>g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1008 kJ·mol-1;
答案:CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1008 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
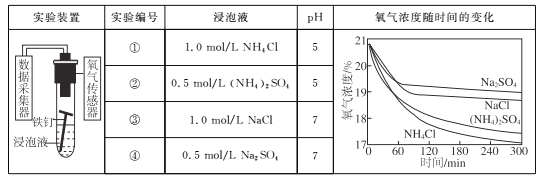
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
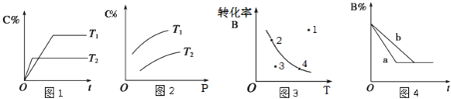
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应室(容积恒定为2 L)中有反应:A(g)+2B(g)=C(g)。
(1)能说明上述反应达到平衡状态的是________(填字母,下同)。
A.反应中A与B的物质的量浓度之比为1∶2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2v正(A)=v逆(B)
(2)1 mol A(g)与2 mol B(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如图所示:
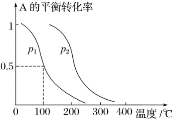
①p1________(填“<”、“>”或“=”,下同)p2,正反应的ΔH________0。
②下列措施中一定能使c(C)/c(A)增大的是________。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(3)100 ℃时将1 mol A和2 mol B通入反应室,保持温度不变,10 min末C(g)的浓度为0.05 mol·L-1,则10 min末B的转化率为________,此时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。_________________
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,锂电池已扩展到镍酸锂、钴酸锂、硅碳负极、磷酸铁锂等电池体系。请回答下列问题:
(1)基态Ni原子的价电子排布式为________,与Ni同周期且基态原子核外的成单电子数与Ni相同的元素还有__________种。
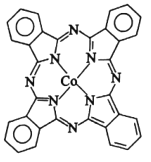
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,分子中氮原子的杂化类型为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸。实验证实O2因具有单电子而成为顺磁性分子。下列结构式(黑点代表电子)中最有可能代表O2分子结构的是__(填字母)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(4)如图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是______。
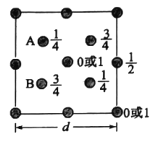
(5)PCl5晶体的晶胞如图所示,该晶体熔融时形成一种能导电的液体,实验测得其中含有一种正四面体阳离子和一种正八面体阴离子,且P—Cl键的键长只有198pm和206pm两种,试用电离方程式解释PCl5熔体能导电的原因____,正四面体形阳离子中键角大于PCl3的键角原因为_____。已知该晶体的晶胞边长为apm,NA为阿伏伽德罗常数的值,则该晶体的密度为__________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院上海硅酸盐研究所开发出基于硫化银(![]() )柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的
)柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的![]() 薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
(1)Ag的核外电子排布式是![]() ,则Ag在元素周期表中的位置是____。下列关于
,则Ag在元素周期表中的位置是____。下列关于![]() 的电子排布式书写正确的是____(填标号)。
的电子排布式书写正确的是____(填标号)。
a.![]() b.
b.![]() c.
c.![]()
(2)乙硫醇(![]() )是一种含硫有机物,和醋酸银可发生下列反应:
)是一种含硫有机物,和醋酸银可发生下列反应:![]()
乙硫醇中S原子的杂化类型是______。乙酸中羧基碳原子的杂化类型是_____,乙酸中含有的![]() 键数:
键数:![]() 键数=_____。
键数=_____。
(3)Cu与Ag为同族元素,熔点:Cu________Ag(填“>”或“<”),原因是________________。
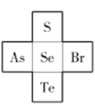
(4)S、Se、Te在元素周期表中与其他元素的位置关系如下图所示,则Te、As、Se、Br的第一电离能由大到小的顺序为________,![]() 的空间构型为________。
的空间构型为________。
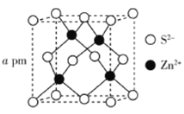
(5)ZnS的晶胞结构如下图所示,其密度为![]() ,晶胞边长
,晶胞边长![]() ________pm(用含
________pm(用含![]() 、
、![]() 的代数式表示,
的代数式表示,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com