
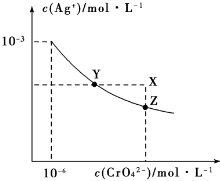
 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
分析 A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,仍为饱和溶液;
B.t℃X点Qc>Ksp,有Ag2CrO4沉淀生成,沉淀溶解平衡为吸热反应;
C.饱和Ag2CrO4溶液中加入少量AgNO3固体,c(Ag+)增大,溶解平衡逆向移动;
D.Ksp=c2(Ag+)c(CrO42-).
解答 解:A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,仍为饱和溶液,c(CrO42-)不能减小,则不能使溶液由Y点变到Z点,故A错误;
B.t℃X点Qc>Ksp,有Ag2CrO4沉淀生成,沉淀溶解平衡为吸热反应,则X点没有Ag2CrO4沉淀生成,此时温度高于t℃,故B错误;
C.饱和Ag2CrO4溶液中加入少量AgNO3固体,c(Ag+)增大,溶解平衡逆向移动,则c(CrO42-)减小,可使溶液由Z点到Y点,故C正确;
D.t℃时,Ag2CrO4的Ksp=c2(Ag+)c(CrO42-)=(10-3)2×(10-6)=1×10-12,故D错误;
故选C.
点评 本题考查难溶电解质平衡,为高频考点,把握溶解平衡移动、Ksp的计算为解答的关键,侧重分析与应用能力的考查,注意图象的分析及离子浓度变化,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
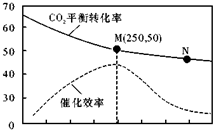 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
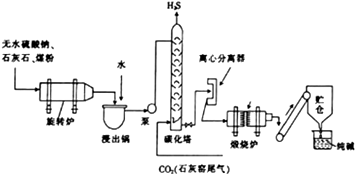 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
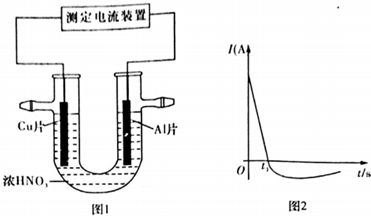
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
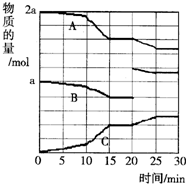
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com