
| A. | 1mol氧 | B. | 1molH2SO4 | C. | 1mol米 | D. | 1mol面粉 |
科目:高中化学 来源: 题型:解答题




 (注明反应条件),因此,在碱性条件下,由Ⅳ与
(注明反应条件),因此,在碱性条件下,由Ⅳ与 反应生成Ⅱ,其反应类型为取代反应.
反应生成Ⅱ,其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小 | B. | X的转化率变大 | ||
| C. | Y的转化率变大 | D. | 新平衡时X的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水 阴极:Na++e-═Na | |
| B. | 电镀铜时(电解质溶液为CuSO4溶液) 阳极:Cu-2e-═Cu2+ | |
| C. | 电解熔融NaCl 阴极:Na++e-═Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 | |
| B. | 需要加热的反应说明它是吸热反应 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O,△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 1molS完全燃烧放热297.3kJ,其热化学方程式:S+O2═SO2,△H=-297.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
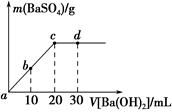 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molH2的质量是1 g | |
| B. | 1 mol HCl的质量是36.5 g•mol-1 | |
| C. | Cl2的摩尔质量等于它的相对分子质量 | |
| D. | SO42-的摩尔质量是96 g•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com