
| A. | ③④ | B. | ③④⑤ | C. | ①③④⑤ | D. | 全部 |
分析 Al、Al2O3、Al(OH)3、醛基弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和稀硫酸、NaOH反应,据此分析解答.
解答 解:①NaHCO3为醛基弱酸酸式盐,能和稀硫酸反应生成硫酸钠、二氧化碳和水,能和NaOH反应生成碳酸钠和水,故正确;
②(NH4)2CO3属于弱酸的铵盐,能和稀硫酸反应生成硫酸铵和二氧化碳、水,能和NaOH反应生成碳酸钠、一水合氨,故正确;
③Al2O3属于两性氧化物,能和稀硫酸、NaOH溶液反应生成盐和水,故正确;
④Al(OH)3属于两性氢氧化物,能和稀硫酸、NaOH溶液反应生成盐和水,故正确;
⑤Al能和稀硫酸、NaOH溶液反应生成盐和氢气,故正确;
故选D.
点评 本题考查元素化合物性质,为高频考点,明确元素化合物性质及物质之间的转化是解本题关键,侧重考查学生总结归纳能力,熟练掌握元素化合物性质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
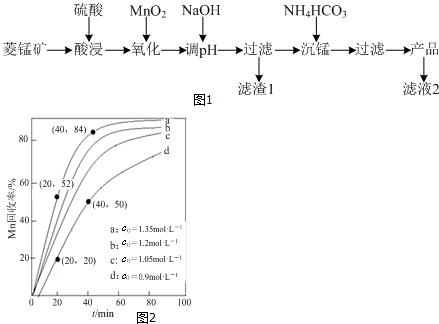
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都含有卤原子 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水,密度比水小的液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com