
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。
(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
(1)Na+[∶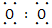 ∶]2-Na+
∶]2-Na+
(2)N2H4·H2O N2
N2 +OH-
+OH-
(3)①NaOH(或其他合理答案) ②Na2O(或其他合理答案)
(4) N2H4-4e-+4OH- N2+4H2O 75%
N2+4H2O 75%
【解析】由②可知A是原子半径最小的H,E为短周期元素原子半径最大的Na,由③可知D为O,结合①可知B、C、D在元素周期表中的大致位置为
,由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶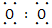 ∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)=0.15 mol,转移电子0.6 mol;n(N2H4)=0.2 mol,转移电子0.8 mol,所以燃料利用率为
∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)=0.15 mol,转移电子0.6 mol;n(N2H4)=0.2 mol,转移电子0.8 mol,所以燃料利用率为 ×100%=75%
×100%=75%


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
1 L某混合溶液,可能含有的离子如下表。
可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是_________________________。

(2)BC段离子方程式为_______________________________________________。
(3)V1、V2、V3、V4之间的关系为__________________________________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题。
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为_________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
某同学对下列相应反应的离子方程式所作的评价,其中合理的是( )
选项化学反应离子方程式评价
A碳酸氢钠的水解HC +H2O
+H2O H3O++C
H3O++C 正确
正确
BNaHCO3溶液中滴入NaOH溶液HC +OH-
+OH- CO2↑+H2O错误,电荷不守恒
CO2↑+H2O错误,电荷不守恒
C“84消毒液”(有效成分为NaClO溶液)和“洁厕灵”(有效成分为浓盐酸)混合放出氯气ClO-+Cl-+H+ Cl2↑+OH- 正确
Cl2↑+OH- 正确
D少量的FeBr2与过量Cl2反应2Fe2++2Br-+2Cl2 2Fe3++Br2+4Cl- 错误,Fe2+与Br-的物质的量之比与化学式不符
2Fe3++Br2+4Cl- 错误,Fe2+与Br-的物质的量之比与化学式不符
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:填空题
某课外活动小组同学用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:选择题
关于下列说法中正确的是( )
A.用惰性电极电解熔融氯化钠的离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
C.下图为电解足量氯化钠溶液的装置,一段时间后两极收集到气体的体积之比为1∶1

D.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A.Z、N两种元素的离子半径相比,前者较大
B.X、M两种元素的气态氢化物的稳定性相比,前者较弱
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 。

③如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。

②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如右图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com