
| 0.04mol/L |
| 4s |
| 0.08+0.04 |
| 0.1 |
| 0.1-x+2x |
| 0.1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:022
某温度时,把1mol气体A2(单质)与1mol气体B2(单质)放入容积为1L的密闭容器中,使其反应生成气体C,2min后测得容器中c(A2)=0.4mol/L,c(B2)=0.8mol/L,c(C)=0.4mol/L,则此反应的化学方程式为(C的组成必须用A,B表示)________.
查看答案和解析>>
科目:高中化学 来源:2010年辽宁省东北育才学校高一下学期期中考试化学试题 题型:填空题
(10分)某温度时,把1mol/LN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s。
(2)在4s时容器内的压强为开始时的 倍。
(3)在平衡时容器内含N2O4 mol。
(4)在平衡时容器内NO2的浓度为 mol/L。
(5)N2O4的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省东北育才双语学校高一下学期期中考文科化学卷(带解析) 题型:填空题
已知NO2和N2O4可以相互转化: N2O4 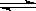 2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省东北育才双语学校高一下学期期中考文科化学卷(解析版) 题型:填空题
已知NO2和N2O4可以相互转化: N2O4 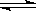 2NO2,某温度时,把1mol
N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol
N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,把1mol/LN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s。
(2)在4s时容器内的压强为开始时的 倍。
(3)在平衡时容器内含N2O4 mol。
(4)在平衡时容器内NO2的浓度为 mol/L。
(5)N2O4的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com