
【题目】将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况).另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为( )
A.66.4 g
B.50.8 g
C.44.8g
D.39.2g
【答案】B
【解析】解:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),物质的量为 ![]() =0.3mol,根据电子转移守恒可知n(Al)=
=0.3mol,根据电子转移守恒可知n(Al)= ![]() =0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,
=0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,
将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为 ![]() ×3=1.8mol,故Fe、Cu共提供的电子物质的量为1.8mol﹣0.6mol=1.2mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH﹣)=1.2mol,所以反应后沉淀的质量等于35.8g﹣5.4g+1.2mol×17g/mol=50.8g,
×3=1.8mol,故Fe、Cu共提供的电子物质的量为1.8mol﹣0.6mol=1.2mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH﹣)=1.2mol,所以反应后沉淀的质量等于35.8g﹣5.4g+1.2mol×17g/mol=50.8g,
故选B.
【考点精析】本题主要考查了铝的化学性质的相关知识点,需要掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应才能正确解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力。
(1)维生素C俗名为___________。在一支盛有2 mL 2%淀粉溶液的试管中滴入2滴碘水,溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变化为_________,该实验说明维生素C具有________性。
(2)如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是________,属于防腐剂的是________,属于糖类的是___________。

(3)市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是_______(填字母)。
a.加锌盐 b.加碘盐 c.加钙盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1993年,中国学者许志福和美国穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法中错误的是( )
A.是烃类化合物
B.常温下是固体
C.是高分子化合物
D.易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A. 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1
B. 分别加水稀释100倍后,两种溶液的pH仍相同
C. 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D. 分别加入足量锌片,两种溶液生成H2的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化在给定条件下能实现的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO.
MgO.
A.4项
B.3项
C.2项
D.1项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 自然界中存在大量的单质硅
B. 石英、水晶、硅石的主要成分都是二氧化硅
C. 二氧化硅的化学性质活泼,能跟酸或碱的溶液发生化学反应
D. 自然界中硅元素都存在于石英中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20.0 mL 0.10mol/L 氨水中滴入0.10 mol/L的盐酸。溶液的pH与所加盐酸的体积关系如图所示。已知氨水的电离度为1.32%,下列有关叙述正确的是( )
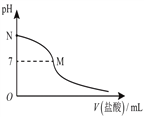
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中![]()
D. N点处的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合材料的使用使导弹的射程有了很大的提高,其主要原因是( )
A.复合材料的使用可以使导弹经受超高温的变化
B.复合材料的使用可以使导弹的质量减轻
C.复合材料的使用可以使导弹承受温度的剧烈变化
D.复合材料的使用可以使导弹承受超高强度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,则H3PO2(aq)中离子浓度的顺序为:__________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,磷元素的化合价为_____
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___(填化学式);
③NaHPO2为____(填“正盐”或“酸式盐”),其溶液显_____(“弱酸性”,“中性”或“弱碱性”).
(3)H3PO2的工业制法是将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H3PO2),后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):
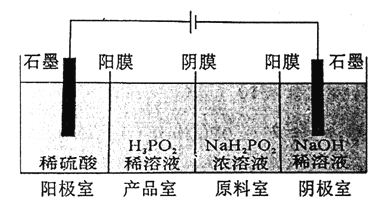
①写出阳极的电极反应式:___________②分析产品室可得到H3PO2的原因:__________
(5)磷酸(H3PO4) 在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
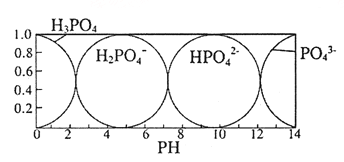
①向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为______。
②从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是_______。(填选项字母)
A、c(Na+) >c(H2PO4-) >c(H+) >c(HPO42-) >c(H3PO4)
B、c(Na+) >c(H2PO4-) >c(OH-)>c(H3PO4) >c(HPO42-)
C、c(H+)+ c(Na+)= c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(H3PO4)
D、c(Na+)= c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)
③假设在25℃时测得0.1 mol·L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=______mol·L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com