
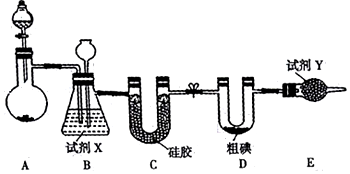
分析 实验室可用如图装置制取ICl3:装置A是Ca(ClO)2)和浓盐酸反应制取氯气,盐酸易挥发,反应制取的氯气中含有氯化氢、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据B中内外液面高低变化,可以判断是否发生堵塞,同时利用饱和食盐水除去氯气中的氯化氢,装置C是利用硅胶吸收水蒸气,装置D碘和氯气反应生成ICl3,氯气有毒需进行尾气处理,E装置吸收多余的氯气,防止污染空气,为碱石灰,据此分析解答.
解答 解:(l)漂白粉固体和浓盐酸反应生成氯化钙、氯气和水,化学方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(2)装置B中试剂X吸收氯气中的氯化氢气体,用饱和食盐水,装置E中的试剂Y吸收多余的氯气,并防止空气中的水蒸气进入装置,选用碱石灰;
故答案为:饱和食盐水;碱石灰;
(3)装置B,除去Cl2中的HCl气体,作安全瓶,监测实验进行时C中是否发生堵塞,C发生堵塞时,B中压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升;装置E吸收多余的氯气,防止污染空气;同时防止空气中水蒸气进人装置;
故答案为:除去Cl2中的HCl气体,同时作安全瓶,监测装置C中是否发生堵塞;吸收多余的氯气,防止污染空气;同时防止空气中水蒸气进人装置;
(4)因水浴能简便控制加热的温度,且能使受热反应试管受热均匀,由于氯气与单质碘需在温度稍低于70℃下反应,应采取水浴加热;
故答案为:水浴加热;
(5)ICl3样品加入适量水和过量KI晶体,充分反应:ICl3+3KI═2I2+3KCl,碘与淀粉作用显蓝色,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),终点现象为当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色,令样品中ICl3的物质的量x,则根据化学反应可得关系式:
ICl3~2I2~4S2O32-,
1 4
x 2 mol•L-1×20×10-3L 解得:x=1×10-2mol,该样品中ICl3的质量分数为:$\frac{0.01mol×233.5g/mol×\frac{100mL}{25mL}}{10g}$=93.4%;
故答案为:ICl3+3KI═2I2+3KCl;当加入最后一滴标准液时,溶液由蓝色褪为无色且半分钟内不恢复;93.4%.
点评 本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用及ICl3制备原理为解答的关键,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
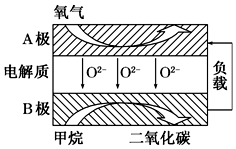 以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )
以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )| A. | 以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池 | |
| B. | A电极为电池正极,发生还原反应 | |
| C. | B电极反应式为CH4+4O2--8e-═CO2+2H2O | |
| D. | 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol•L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为22.4L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 食盐水和泥沙 | D. | 乙酸丁酯和1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在T°C时,某溶液中c(H+)=$\sqrt{{K}_{W}}$,则该溶液一定显中性 | |
| B. | 25°C时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性 | |
| C. | 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多 | |
| D. | 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中存在的微粒种类:a>b | B. | c(NH4+):a>b | ||
| C. | c(OH-):a<b | D. | 水电离出的c(H+):a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | 小苏打受热易分解 | 焙制糕点 |
| B | 蛋白质受热变性 | 高温杀死流感病毒 |
| C | SO2具有漂白性 | 漂白滋补品银耳等食品 |
| D | Al(OH)3分解吸收大量热量并有水生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com