
��֪����H2(g) �� 0.5O2(g) ��H2O(g) ��H1��a kJ/mol�� ��2H2(g) �� O2(g) �� 2H2O(g)��H2��b kJ/mol����H2(g) �� 0.5O2(g) ��H2O(l) ��H3��c kJ/mol
��2H2(g) �� O2(g) �� 2H2O(l) ��H4��d kJ/mol�����й�ϵʽ����ȷ����
| A��a��c��0 | B��b��d��0 | C��2a��b��0 | D��2c��d��0 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪(1)H2(g)�� O2(g)��H2O(g)�� DH1��akJ��mol-1
O2(g)��H2O(g)�� DH1��akJ��mol-1
(2)2H2(g)��O2(g)��2H2O(g) �� DH2��b kJ��mol-1
(3)H2(g)�� O2(g)��H2O(l) �� DH3��c kJ��mol-1
O2(g)��H2O(l) �� DH3��c kJ��mol-1
(4)2H2(g)��O2(g)��2H2O(l) �� DH4��d kJ��mol-1
���й�ϵʽ����ȷ����
| A��a��c��0 | B��b��d��0 | C��2a��b��0 | D��2c��d��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪25�桢101kPa�£���ͼ��ʾ��ʯī��ȼ����Ϊ393��5kJ/mol�����ʯ��ȼ����Ϊ395��0kJ/mol ������˵���������ȷ���ǣ�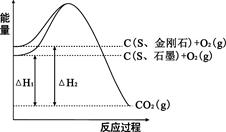
| A�����ʯ��ʯī�ȶ� |
| B��C��s��ʯī����C��s�����ʯ����H ����1��5kJ/mol |
| C����H1����H2 |
| D�����ʹ�ô�������H1�͡�H2����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪298 K��101 kPa�����£�
��4Al(s)��3O2(g)=2Al2O3(s) ��H����2834.9 kJ��mol��1
��4Al(s)��2O3(g)=2Al2O3(s) ��H����3119.1 kJ��mol��1
�ɴ˵ó�����ȷ�����ǣ� ��
| A����������O2��O3�����ͣ���O2��ΪO3Ϊ���ȷ�Ӧ |
| B��O3��O2�ȶ�����O2��ΪO3Ϊ���ȷ�Ӧ |
| C��O2��O3�ȶ�����O2��ΪO3Ϊ���ȷ�Ӧ |
| D����������O2��O3�����ͣ���O2��ΪO3Ϊ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����йػ�ѧ��Ӧ�����仯������һ����ȷ����
| A�����������������ڷ�Ӧ�����������÷�ӦΪ���ȷ�Ӧ |
| B��һ����ѧ��Ӧ��Ҫ���Ȳ��ܽ��У��÷�ӦΪ���ȷ�Ӧ |
| C��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ����Ļ�ѧ��Ӧ�ʱ� |
| D��ͬ��ͬѹ�£�H2(g)��Cl2��g��===2HCl��g���ڹ��պ͵�ȼ������?H��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й���ȼ���Ⱥ��к��ȵıȽ��У��������
| A�����߶�Ӧ��Ӧ�ġ�H��С��0 |
| B�����ߵĵ�λ��ΪkJ��mol-1����mol��1�ĺ��岻ͬ |
| C�����ߵ���ֵ�����淴Ӧ�������ı���ı� |
| D�����ߵ���ֵ���淴Ӧ��ı���ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪: ��1��NH3(g��+HCl(g)=NH4Cl(s); ��H1=-76kJ��mol��1
��2��NH3(g��+H2O(l)=NH3��H2O(aq); ��H2=-35.1kJ��mol��1
��3��HCl(g��+HCl (aq); ��H3=-72.3kJ��mol��1
��4��HCl (aq) NH3��H2O(aq) =NH4Cl(aq��+H2O(l); ��H4=-52.3kJ��mol��1
��5��NH4Cl(s��=NH2Cl(aq); ��H5=?
���ݸ�˹����,��5������ʽ�еķ�Ӧ�ȡ�H5Ϊ
| A��-335.7 kJ��mol��1 | B��-16.3 kJ��mol��1 |
| C��+16.3 kJ��mol��1 | D��-83.7 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�ɽ��ʯ(TiO2)��ȡ����Ti�漰���IJ���Ϊ��
TiO2 TiCl4
TiCl4 Ti
Ti
��֪����C(s)��O2(g)��CO2(g) DH��-393.5kJ��mol-1
��2CO(g)��O2(g)��2CO2(g) DH��-566kJ��mol-1
��TiO2(s)��2Cl2(g)��TiCl4(s)��O2(g) DH��+141kJ��mol-1
��TiO2(s)��2Cl2(g)��2C(s)��TiCl4(s)��2CO(g)��DH��
| A����80kJ��mol-1 | B����160kJ��mol-1 | C��160kJ��mol-1 | D��80kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��20g Ba��OH�� ��8H
��8H O������10 g NH
O������10 g NH Cl����һ�����С�ձ��У����ձ����ڵ���3��4��ˮ�IJ���Ƭ�ϣ��ò�����Ѹ�ٽ��衣������˵����ȷ����
Cl����һ�����С�ձ��У����ձ����ڵ���3��4��ˮ�IJ���Ƭ�ϣ��ò�����Ѹ�ٽ��衣������˵����ȷ����
| A��ʵ���в������������Ǽ��ٹ����ܽ� |
| B������Ƭ�Ͻ������С�ձ�ճ��һ��˵���÷�Ӧ�Ƿ��ȷ�Ӧ |
| C����ȡ��Ӧ�������Ķ��ٻ�Ӱ�췴Ӧ�����ȣ����Ƿ��� |
| D���÷�Ӧ�У���Ӧ���������С��������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com