
����Ŀ��������������� ![]() ����һ�����ϣ�һ�ֺϳ�·�����£�
����һ�����ϣ�һ�ֺϳ�·�����£� 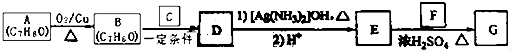 ��֪������Ϣ��
��֪������Ϣ��
�� ![]() ��
��
��CΪ��ȩ��ͬϵ���ͬ���������������������ܶȱ�Ϊ22��
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ ��
��2��B��C��Ӧ����D�Ļ�ѧ����ʽΪ ��
��3��F�к��й����ŵ�����Ϊ ��
��4��E��F��Ӧ����G�Ļ�ѧ����ʽΪ �� ��Ӧ����Ϊ ��
��5��F��ͬ���칹���в���������Ʒ�Ӧ���������Ĺ����֣������������칹�������к˴Ź�������ֻ������壬�ҷ������Ϊ3��1��Ϊд�ṹ��ʽ����
���𰸡�
��1�����״�
��2��![]() +CH3CHO
+CH3CHO ![]() ?
? ![]() +H2O
+H2O
��3���ǻ�
��4��![]() +��CH3��2CHCH2CH2OH
+��CH3��2CHCH2CH2OH ![]() ?
? ![]() +H2O��������Ӧ
+H2O��������Ӧ
��5��6����CH3��3COCH3
���������⣺A�IJ����Ͷ�Ϊ ![]() =4��A����ϵ��ת���ϳ������������G��
=4��A����ϵ��ת���ϳ������������G�� ![]() ������A������������֪AΪ
������A������������֪AΪ ![]() ����BΪ
����BΪ ![]() ��������Ϣ�ɵ�B��C��ӦΪ��ȩ���ϣ����G�Ľṹ���жϳ��õ�����ȩ����CΪCH3CHO����DΪ
��������Ϣ�ɵ�B��C��ӦΪ��ȩ���ϣ����G�Ľṹ���жϳ��õ�����ȩ����CΪCH3CHO����DΪ ![]() ��EΪ
��EΪ ![]() ��FΪ��CH3��2CHCH2CH2OH.
��F��CH3��2CHCH2CH2OH.
��1.��������������֪��AΪ ![]() ������Ϊ���״������Դ��ǣ����״���
������Ϊ���״������Դ��ǣ����״���
��2.��B��C��Ӧ����D�Ļ�ѧ����ʽΪ�� ![]() +CH3CHO
+CH3CHO ![]()
![]() +H2O�����Դ��ǣ�
+H2O�����Դ��ǣ� ![]() +CH3CHO
+CH3CHO ![]()
![]() +H2O��
+H2O��
��3.��FΪ��CH3��2CHCH2CH2OH�����й����ŵ�����Ϊ�ǻ������Դ��ǣ��ǻ���
��4.��E��F��Ӧ����G�Ļ�ѧ����ʽΪ�� ![]() +��CH3��2CHCH2CH2OH
+��CH3��2CHCH2CH2OH ![]()
![]() +H2O������������Ӧ�����Դ��ǣ�
+H2O������������Ӧ�����Դ��ǣ� ![]() +��CH3��2CHCH2CH2OH
+��CH3��2CHCH2CH2OH ![]()
![]() +H2O��������Ӧ��
+H2O��������Ӧ��
��5.����CH3��2CHCH2CH2OH��ͬ���칹�岻��������Ʒ�Ӧ��ֻ�����ѣ��ѵ��칹������ԭ��Ϊ�ֽ磺����1��̼��4��̼����������������4���칹��������4���칹�壬����2��̼��3��̼����������������2���칹��������2���칹�壬��6�֣����к˴Ź�������ֻ������壬�ҷ������Ϊ3��1��Ϊ��CH3��3COCH3 ��
���Դ��ǣ�6����CH3��3COCH3 ��


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ�ȹ�ϵ��ȷ���ǣ�������
A. 0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH-����c��SO42-����c��H+��
B. ����CO2ͨ��0.1mol/LNa2CO3��Һ����Һ���ԣ�����Һ�У� 2c��CO32-��+c��HCO3-��=0.1mol/L
C. 0.1mol/L��NaOH��Һ��0.2mol/L��HCN��Һ�������ϣ�������Һ�ʼ��ԣ�c��Na+����c��CN-����c��HCN����c��OH-����c��H+��
D. ��1L 1mol/L��KOH����Һ��ͨ��һ������Cl2��ǡ����ȫ��Ӧ��������ء�������غ��Ȼ��صĻ����Һ��c��K+��+c��H+��=6c��ClO3-��+2c��ClO-��+c��HClO��+c��OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����Ȼ�隣������̿��Ʊ�̼���̵���������ͼ��ʾ��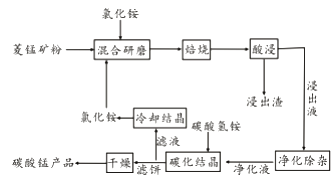
��֪�������̿����Ҫ�ɷ���MnCO3 �����к�Fe��Ca��Mg��Al��Ԫ�ء�
�ڱ��չ�������Ҫ��ӦΪ��MnCO3 +2NH4Cl ![]() MnCl2+2NH3�� +CO2��+ H2O��
MnCl2+2NH3�� +CO2��+ H2O��
�۲��������ӳ���ʱ��Һ��pH��ֵ��
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
��ʼ������pHֵ | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
������ȫ��pHֵ | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
��1��ʵ���ҡ����ա�����ʢ�Ź��������Ϊ��
��2�����ͼ1��2��3���������չ����ж��¶ȡ�NH4Cl����[m��NH4Cl����m���̿�ۣ�]��ʱ������ѡ������Ϊ������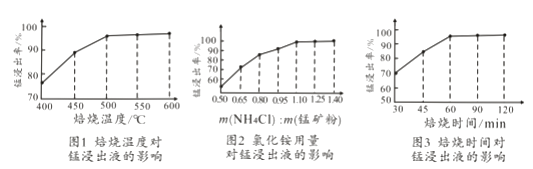
��3�����̽���Һ��������ʱ���ȼ���MnO2��Fe2��ת��ΪFe3�� �� �ٵ�����ҺpH�ķ�ΧΪ �� ��Fe3����Al3����Ϊ������ȥ��Ȼ�����NH4F��Ca2����Mg2����Ϊ�����������ȥ��
��4����̼���ᾧ�������У�����̼������Ƿ�Ӧ�����ӷ���ʽΪ��
��5�����������п�ѭ��ʹ�õ���������
��6��Ϊ�ⶨ��Ʒ��̼���̵ĺ������������ʵ�飨���ʲ��μӷ�Ӧ����ʵ�鲽��Ϊ����ȡ16.80g����������������ϡ������Һ�У���������Һ�м����Թ�������������ᣬ����ʹ��Ӧ��2Mn2++NO3-+4PO43-+2H+ ![]() 2[Mn(PO4)2]3-+NO2-+H2O��ֽ��С���ȥ��Һ�д��ڵ�NO3-��NO2-����l00.00mL2.00 mol��L-1��(NH4)2Fe(SO4)2��Һ�������ķ�ӦΪ��[Mn(PO4)2]3-+Fe2��=Mn2++Fe3��+2PO3-������1.00mol��L-1����K2Cr2O7��Һ�ζ�������Fe2�� �� �ζ��յ�ʱ����10.00mL����K2Cr2O7��Һ��
2[Mn(PO4)2]3-+NO2-+H2O��ֽ��С���ȥ��Һ�д��ڵ�NO3-��NO2-����l00.00mL2.00 mol��L-1��(NH4)2Fe(SO4)2��Һ�������ķ�ӦΪ��[Mn(PO4)2]3-+Fe2��=Mn2++Fe3��+2PO3-������1.00mol��L-1����K2Cr2O7��Һ�ζ�������Fe2�� �� �ζ��յ�ʱ����10.00mL����K2Cr2O7��Һ��
������K2Cr2O7��Һ��Fe2����Ӧ�����ӷ���ʽΪ����ԭ������Cr3������
�ڲ�Ʒ��̼���̵���������Ϊ���������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ĸ��Թ��У��������·�Ӧ��Zn+2HCl=ZnCl2+H2��������H2�ķ�Ӧ������С���ǣ�������
�Թ� | ����Ũ�� | �¶� | п��״̬ |
A | 0.5molL��1 | 20�� | �� ״ |
B | 0.5molL��1 | 20�� | ��ĩ״ |
C | 2molL��1 | 35�� | �� ״ |
D | 2molL��1 | 35�� | ��ĩ״ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ����������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������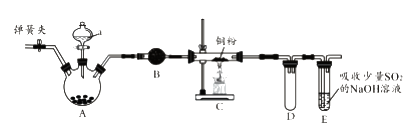
��1��A�й���������أ�Һ��a��Ũ���ᣬд���÷�Ӧ�Ļ�ѧ����ʽ����
��2��BΪ����װ�ã�����Ĺ�������������������A��B��Ӧ����һ��ʢ����ϴ��ƿ��
��3��C�еķ�Ӧ��������D����������
��4����֪E�з����ķ�ӦΪ��Cl2+Na2SO3+2NaOH ![]() 2NaCl+Na2SO4+H2O��E������β��һ��ʱ�������Һ��ǿ���ԣ��п϶����ڣ�Cl-��OH-��SO42-��ij��ȤС����Ϊ������Һ�л����ܴ���ClO-��SO32-��
2NaCl+Na2SO4+H2O��E������β��һ��ʱ�������Һ��ǿ���ԣ��п϶����ڣ�Cl-��OH-��SO42-��ij��ȤС����Ϊ������Һ�л����ܴ���ClO-��SO32-��
a����ͬѧ��Ϊ������Һ��ClO-��SO32-����ͬʱ���ڣ����������������ӷ���ʽ��ʾ����
b����ͬѧΪ�˼�������Һ���Ƿ���SO32- �� ȡ��������Һ���Թ��У�������ϡ�����ữ�μ�Ʒ����Һ������Ʒ����Һ��ɫ���ݴ��ƶϸ�����Һ��һ����SO32-����ͬѧ���ƶ��Ƿ���ȷ�������ȷ������ȷ��������������
c�������ʵ���������Һ���Ƿ���ClO-��д��ʵ�鲽�衢����ͽ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ��Ƶ����ǣ� ��
A.�����Ӻ�������B.�Ȼ��Ʒ���
C.��ԭ�Ӻ���ԭ��D.�����ƺͷǽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�ͽ�����ķ�����
A. ��������� B. ����ζ
C. ���� D. ���ݷ�ɢ����ֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ڻ���ˮ����ת��Ϊˮ����ʱ��һ���� ��
A.�ȷų�����������������B.�������������ٷų�����
C.ֻ�ų�����D.ֻ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۼ��ǹ���������ȡ����������ָ�Ƶ�һ����Ҫ�ķ�����AgNO3���ַ���������һ�֣��˵������к��գ����ֶ�����ֽ����ָ���߾�����ֽ�ϡ��������Һ��С��Ϳ��ֽ�ϣ���Һ���е����ʾ������е����������ã��������������������ڹ����£��ֽ���������ʻҺ�ɫ�����ŷ�Ӧ�Ľ��У����������࣬����ɫ��ɺ�ɫ��ָ���ߡ������л�ѧʽ��ʾ���������ʶ���ȷ���� (�� )
A����AgNO3����NaBr����AgBr B����AgNO3����NaCl����AgCl
C����AgCl�� ��AgNO3����NaCl D����AgNO3����NaCl����Ag
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com