
��A�������������Se�����ڣ�Te����Ԫ���ڻ������г����ֳ����ֻ��ϼۣ�����A��Ԫ�صĻ��������о�����������������Ҫ��;����ش��������⣺
��1����Ԫ�����γɷ�����������д��һ����CO2�ȵ��ӵĻ�����_________________��
��2����Na2O��SiO2��P2O5���������ﰴ�۷е��ɸߵ���˳������_________________��
��3��ԭ�ӵĵ�һ��������ָ��̬�����Ի�̬ԭ��ʧȥһ������ת��Ϊ��̬��̬����������Ҫ�����������O��S��Seԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ_________________��
��4��Seԭ�ӻ�̬������ӵ��Ų�ʽΪ_________________��
��5��SO32-��������ԭ�ӵ��ӻ���ʽ__________�������ӵ����幹��Ϊ____________��
��6��ij����Ԫ��A���������������������������ϡ������������������ľ����ṹ��ͼ��ʾ�����������Ļ�ѧʽΪ____________��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ��ˮ�и�һ�ϵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������ʻ�Ϻ��������������Ƶ��ǣ� ��
A���ƺ�ˮ B���������ƺ�ˮ
C�� ����������Һ��̼������Һ D������������Һ���Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ��12���¿���ѧ�Ծ�����ʦ�棩 ���ͣ�ѡ����
�����Է���Ӧ���������о������͵���
A��2H2(g)+O2(g)=2H2O(l) ��H ����285.8kJ/mol
B��2N2O5(g)��4NO2(g)+O2(g) ��H ����56.7kJ/mol
C��(NH4)2CO3(s) =NH4HCO3(s)+NH3(g) ��H ����74.9kJ/mol
D��������Է�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ˳���и����ϵ��Ĵ��¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
CO��H2�Ļ�������׳ƺϳ�������һ����Ҫ�Ĺ�ҵԭ��������ҵ��������Ȼ������Ҫ�ɷ�ΪCH4����ˮ���и��������Ʊ��ϳ�����
CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+206.1KJ/mol
��1����һ���¶��£������Ϊ2L���ܱ������г���0.40mol CH4��0.60mol H2O(g)�����CH4(g)��H2(g)�����ʵ���Ũ����ʱ��仯���±���ʾ��

�ټ���÷�Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ������ʽK=�ߣߣߣߣߣߣ�
��3minʱ�ı�ķ�Ӧ�����������ߣߣߣߣߣߣߣ���ֻ��һ�������ĸı伴�ɣ���
��2����֪�¶ȡ�ѹǿ��Ͷ�ϱ�X[n(CH4)/n(H2O)]�Ը÷�Ӧ��Ӱ����ͼ��ʾ��
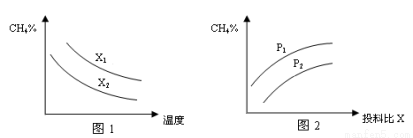
��ͼ1�е�����������ʾͶ�ϱȵĹ�ϵX1�ߣߣߣ�X2(�=������>����<����ͬ)��
��ͼ2������������ʾ��ѹǿ�ȵĹ�ϵ��P1�ߣߣߣ�P2��
��3�� ����Ȼ���������ʲ����뷴Ӧ����KOH��ҺΪԭ�Ͽ���Ƴ�ȼ�ϵ�أ�
�ٷŵ�ʱ�������ĵ缫��ӦʽΪ �ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣ�
����װ����ʢ�е� KOH��Һ���ڷ�Ӧ��ǡ������KHCO3��Һ�������Һ�и�����Ũ���ɴ�С�Ĺ�ϵΪ�ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
����Ԫ���������о�Ԫ�ؼ��仯��������ʾ�����Ҫ�����塣
I.���ֶ���������Ԫ�ص�����������Ӧ��ˮ���Ũ�Ⱦ�Ϊ0.01mol.L-1)��Һ��PH��ԭ�������Ĺ�ϵ����ͼ��ʾ��
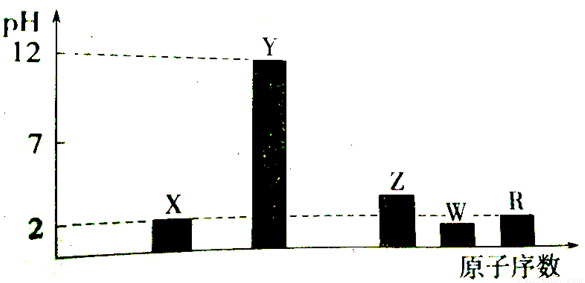
��1��Ԫ��R�����ڱ��е�λ���� ��
��2��Ԫ��Y��W�γɵ�Y2W2�ͻ������к��л�ѧ��������Ϊ ��
��3���ⶨZԪ������������Ӧˮ������Һ���ʵ���Ũ�ȵķ���Ϊ ��
II.������Ԫ��C��O��S���γɶ��ֻ������CO2��CS2��COS��
��1��������˵��̼��������Ԫ�طǽ��������ǿ������ ������ţ�
A����ͬ������ˮ��Һ��PH��Na2CO3 >Na2SO4
B������:H2SO3 >H2CO3
C��CS2��̼Ԫ��Ϊ+4�ۣ���Ԫ��Ϊ-2��
��2���ʻ���COS������Ϊһ��Ѭ�������ܷ�ֹijЩ���桢�߳��Σ��������ӽṹ��CO2����
���ʻ���COS���ĵ���ʽΪ�� ��
���ʻ���COS��������������Һ���������õĹ������£�

��֪A��һ�����Σ���A�Ļ�ѧʽΪ ��������aΪ���ʣ���Ӧ II�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��E��F�����ܱ������У���һ�������·�����Ӧ��E(g)+F(s)  2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ����֪Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������˵����ȷ���ǣ�
2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ����֪Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������˵����ȷ���ǣ�

A��b��f
B��ƽ�ⳣ��K(1000��)��K(810��)
C��915�桢2.0MPa�÷�Ӧ��ƽ�ⳣ��ΪKp=4.5MPa
D��1000�桢3.0MPaʱE��ת����Ϊ83%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������������ѧ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��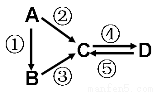
��1����B�ǵ���ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯�D���ʳ�����ʳƷ��ҵ��д���ܷ�Ӧ�Ļ�ѧ����ʽ ��
��2����B����̬�⻯�C��D���������һ���ɹ⻯ѧ������Ⱦ��д���۷�Ӧ�Ļ�ѧ����ʽ ��
��3����D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���塣д���ܷ�Ӧ���ӷ���ʽ ��
��4����A��̫���ܵ���õĹ�����ϡ�C��DΪ���Σ����������г��ơ������Ԫ��Ϊͬһ���壬����Һ���Լ��ԡ�д���ڷ�Ӧ�Ļ�ѧ����ʽ ��
��5����A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʡ�д���ܷ�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪NaHSO3��Һ�����ԣ���Һ�д�������ƽ�⣺
HSO3-+ H2O  H2SO3 + OH- ��
H2SO3 + OH- ��
HSO3- H+ + SO32- ��
H+ + SO32- ��
��0.1mol��L-1��NaHSO3��Һ�зֱ�����������ʣ������й�˵����ȷ����
A��������������NaOH��ƽ������ƣ�ƽ������ƣ���Һ��c(HSO3-)����
B������������Ũ��Na2SO3��Һ����3c(Na+) = 2[c(HSO3-) + c(H2SO3) +c(SO32-)]
C����������NaOH��Һ�� ��
��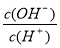 ��ֵ������
��ֵ������
D�����백ˮ�����ԣ���2c(Na+) = c(SO32-)>c(H+) = c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����Ĺ�ԭһ�и�������Ӧ��ѵ�����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
�Ӻ�ˮ����ȡһЩ��Ҫ�Ļ�����Ʒ�Ĺ���������ͼ��ʾ��

������������ͼ�ش��������⣺
��1��ͼ��A�Ļ�ѧʽΪ____________������ȡA�Ĺ���������NaCl��Һ���Ⱥ�ͨ���������壬��ͨ������Ļ�ѧʽΪ_____________________��
��2����ˮ���������ķ�����______________________________����д��3�ּ��ɣ�
��3�����̢ݵĻ�ѧ����ʽΪ_________________________��
��4����B��Һ�Ʊ�B����ˮ����ġ�����a��Ϊ_____________________��
��5�����̢���SO2ˮ��Һ�����嵥�ʣ������ʿɴ�93%����������ǿ�ᣬд����Ӧ�����ӷ���ʽ ______________________________��
��6�����̢ڵ����̢ܵı仯Ϊ��Br����Br2��Br����Br2������Ŀ����_____ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com