
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是
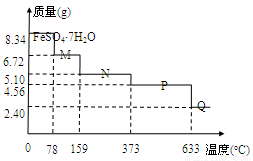
A.在100℃时,M的化学式为FeSO4·4H2O
B.FeSO4·7H2O晶体中有4种不同结合力的水分子
C.FeSO4·H2O存在的最高温度为373℃
D.380℃的P加热至650℃时的化学方程式为:2FeSO4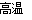 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
B
【解析】
试题分析:8.34 g FeSO4·7H2O 的物质的量是0.03mol。A、在100℃时,M的质量为6.72g,减少了1.62g水,剩余0.12mol的水,所以FeSO4与H2O的物质的量比是1:4,正确;B、晶体中水分子的结合力是相同的,错误;C、FeSO4·H2O中水的物质的量为0.03mol,其质量是5.1g,所以由图可知FeSO4·H2O存在的最高温度为373℃,正确;D、P点对应的物质的质量是4.56g,为FeSO4的质量,Q点的质量是2.4g为Fe2O3的质量,所以从P到Q发生反应的化学方程式为:2FeSO4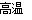 Fe2O3+SO2↑+SO3↑,正确,答案选B。
Fe2O3+SO2↑+SO3↑,正确,答案选B。
考点:考查对图像的分析能力,根据条件计算化学式、化学方程式


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
25℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得
c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省益阳市高三下学期模拟考试理综化学试卷(解析版) 题型:填空题
为了防止或减少机动车尾气和燃煤产生的烟气对空气的污染,人们采取了很多措施。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)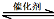 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
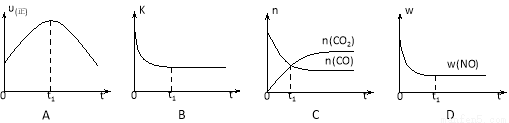
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)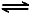 N2O4(g) ΔH=-56.9 kJ/mol ②
N2O4(g) ΔH=-56.9 kJ/mol ②
H2O(g) = H2O(l) ΔH=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过催化剂,通过测量逸出气体中氮氧化物含量,从而可确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g)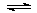 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。

①该反应的△H 0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP= 。
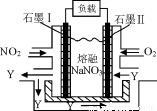
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨I为电池的 极。 该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1︰1)的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:选择题
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<②
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
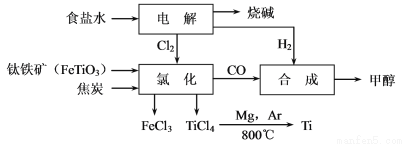
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
①已知该反应在300oC时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,上述产业链中每合成6 mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
有机物A(肉桂酸甲酯)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。它的核磁共振氢谱图上有6个峰,峰面积之比为1:2:2:1:1:3。它的红外光谱如下图:
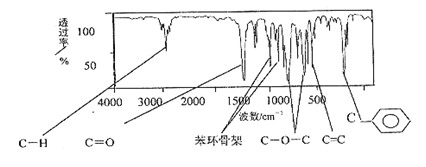
用A为原料合成高分子化合物H的路线如下
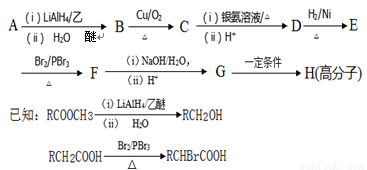
回答下列问题:
(1)A的结构简式是 。
(2)B与Br2的CCl4溶液反应后的生成物中手性碳原子的数目为 。
(3)请写出B生成C的化学方程式 。
(4)请写出同时满足下列条件下C的所有同分异构体的结构简式: 。
①分子中不含羰基和羟基;②是苯的对位二元取代物;③除苯环外,不含其他环状结构。
(5)请写出G生成H的化学方程式 。
(6)溴苯与丙烯酸甲酯在氯化钯催化下可直接合成A,为了促进反应的进行,通常可加入一种显 (填字母)的物质。
A.弱酸性 B.弱碱性 C.强酸性 D.强碱性
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是
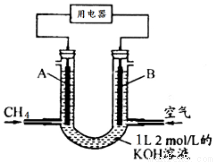
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
海水是巨大的资源宝库,下列说法正确的是
A.碘元素又称“海洋元素”
B.镁是海水中含量最多的金属元素
C.从海水中提取食盐和碘的过程都是物理变化
D.氯碱工业和纯碱工业的原料都有食盐
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列说法中用离子方程式表达正确的是
A.用惰性电极电解氯化钠溶液:2Cl-+2H+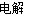 H2↑+Cl2↑
H2↑+Cl2↑
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3 ↓+CO32-
C.Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com