
| A、取样,加入紫色石蕊,溶液变红,一定有H+ |
| B、取样,加入氯化钡溶液有白色沉淀产生.再加盐酸,沉淀不消失,一定有SO42- |
| C、取样,加入硝酸银有白色沉淀,一定有Cl- |
| D、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |


科目:高中化学 来源: 题型:

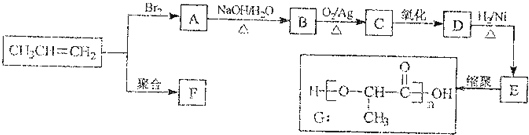
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH值 | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.045mol/L |
| 细菌总数 | <100个?mL-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
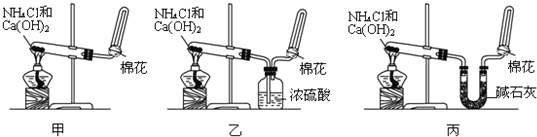

查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:查看答案和解析>>
科目:高中化学 来源: 题型:
 将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )| A、石灰石和稀硝酸 |
| B、CaO和氯化铵 |
| C、Cu和浓硝酸 |
| D、Na2O2和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
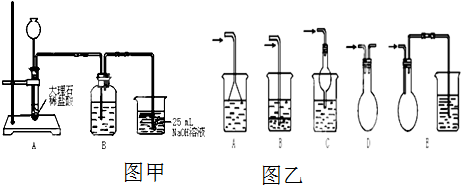
查看答案和解析>>
科目:高中化学 来源: 题型:
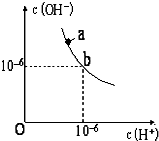 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com