
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
分析 在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,能量低的物质稳定.
解答 解:A、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故A错误;
B、1mol石墨转化为金刚石要吸收1.895kJ的热量,说明1mol石墨比1mol金刚石的总能量低,故B正确;
C、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故C正确;
D、1mol石墨转化为金刚石要吸收1.895kJ的热量,说明1mol石墨比1mol金刚石的总能量低,故D错误;
故选:BC.
点评 本题主要考查金刚石和石墨的转化以及涉及到的能量变化,难度不大,需要掌握的是能量低的物质稳定.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Al3+、NO3-、SO42- | B. | Na+、CI-、Ca2+、NO3- | ||
| C. | OH-、NH4+、Na+、SO42- | D. | Fe3+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化和干馏是物理变化 | |
| B. | 通过石油分馏得到的汽油是纯净物 | |
| C. | 石油裂解是为了得到乙烯、丙烯等气态短链烃 | |
| D. | 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成C的速率与C分解的速率相等 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成n molA,同时生成3n molB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
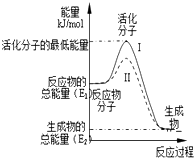 (1)已知:
(1)已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | X在自然界中以游离态和化合态形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com