
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知, t3 ~t4阶段为使用催化剂[已知t0~t1阶段c(B)未画出]。

(1)若 t1=15s,则t0~ t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4~t5阶段改变的条件为 ,B的起始物质的量为 。
(3)t5~t6阶段容器内A的物质的量共减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
【答案】(1)0.004 mol·L-1·s-1 (2)减小压强 0.04 mol
(3)3A (g) ![]() 2C(g)+B(g);ΔH=+100akJ·mol-1
2C(g)+B(g);ΔH=+100akJ·mol-1
【解析】
试题分析:(1)根据图甲知t0~ t1阶段C的浓度变化为0.11 mol·L-1-0.05 mol·L-1=0.06 mol·L-1,t1=15s,则t0~ t1阶段以C浓度变化表示的反应速率为v(C)=△c/△t=0.06 mol·L-1/15s=0.004 mol·L-1·s-1。
(2)根据图乙知t4~t5阶段改变的条件为增大反应物或生成物的浓度,t3 ~t4阶段正、逆反应速率增大的程度相同,为使用催化剂,t4~t5阶段正、逆反应速率减小的程度相同,平衡不移动,则改变的条件为减小压强,则该反应为反应前后气体物质的量不变的反应,结合图甲知该反应的化学方程式为3A (g) ![]() 2C(g)+B(g),A的浓度减小0.09 mol·L-1,则B的浓度增大0.03 mol·L-1,B的起始浓度为0.02 mol·L-1,B的起始物质的量为0.04mol。
2C(g)+B(g),A的浓度减小0.09 mol·L-1,则B的浓度增大0.03 mol·L-1,B的起始浓度为0.02 mol·L-1,B的起始物质的量为0.04mol。
(3)t5~t6阶段改变的条件为升高温度,容器内A的物质的量减少,平衡正向移动,该反应为吸热反应,即A减少0.03 mol吸收的热量为akJ,该反应的热化学方程式为3A (g) ![]() 2C(g)+B(g);ΔH=+100akJ·mol-1。
2C(g)+B(g);ΔH=+100akJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为( )
A.C30H60 B.C30H56 C.C30H52 D.C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图1所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物。
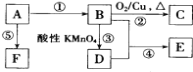
(1)C的结构简式为____。
(2)D分子中官能团的名称____,证明该官能团具有酸性的方法为 。
(3)写出图1转化过程中的化学反应方程式① ____;② ;⑤ 。
(4)写出图1有机反应类型① ______ ;② ______。
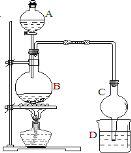
(5) 某课外小组设计的实验室制取乙酸乙酯的装置如图2所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
①浓硫酸的作用是______;
②若用同位素 18O标记乙醇中的氧原子,则CH 3CH 2 18OH与乙酸生成乙酸乙酯的化学方程式为____。
③球形干燥管C的作用是 。
④反应结束后D中的现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知MgO的晶体结构属于NaCl型,MgO晶胞中Mg2+的配位数为 ;与( )距离最近的( )有 个,某同学画出的MgO晶胞结构示意图如图所示,请指出其中错误的是 ( )

(2)铝单质的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图丙所示。

若已知铝原子半径为d cm,NA表示阿伏加德罗常数,铝的摩尔质量为M g/mol,则该晶体的密度可表示为 g/cm3。(填化简结果)。
(3)氢能被视作连接化石能源和可再生能源的重要桥梁;氢的规模化储运是氢能应用的关键。氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料。请写出含有配位键(用“→”表示)的氨硼烷的结构式 ;与氨硼烷互为等电子体的有机小分子是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 二氧化硅可制玻璃、单质硅、光导纤维;
B. 食盐、糖、醋可作调味剂,不可作食品防腐剂;
C. 金属腐蚀的本质是金属原子失电子被氧化的过程;
D. 大量服用阿司匹林会出现水杨酸中毒症,可静脉滴注NaHCO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的 (填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,作用及目的是 。
(5)转移、洗涤。在转移时应使用 引流,需要洗涤 2-3次是为了 。
(6)定容。向容量瓶中加水至液面接近刻度线________处,改用________加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时的液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》说:“水银……镕化(加热)还复为丹。”黄帝九鼎神丹经》 中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。这里的“丹”是指
A. 氯化物 B. 合金 C. 硫化物 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料。为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,某化学兴趣小组设计探究实验,操作过程如图所示:(A试剂有挥发性):
(1)操作过程中的试剂:A是______________盐酸、过滤
,B是______________;氢氧化钠、过滤
;;
(2)溶液甲到溶液乙的离子方程式为______________;
(3)在溶液乙中通入过量C02后发生反应的离子方程式为______________;
(4)如果A、B试剂互换,则C02应换为____________试剂,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______________Al2O3、NaCl
(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话。下列有关媒体的报道与化学知识不相违背的是( )
A. 这种人工皂不含任何化学物质
B. 该科研人员发明了一种特殊催化剂,可以使水变为汽油
C. 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题
D. 该科研机构发明了一种用植物秸秆生产乙醇的新工艺
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com