
| A、C6H12O6(葡萄糖)+6O2→6CO2+6H2O |
| B、CH3COOH+KOH═CH3COOK+H2O |
| C、Mg与HCl反应生成H2 |
| D、胆矾加热变为白色粉末 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
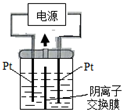 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-═H2↑+2OH- |
| B、电解结束时,右侧溶液中含有IO3- |
| C、电解槽内发生反应的总化学方程式KI+3H2O═KIO3+3H2 |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(A-) |
| c(HA) |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?? H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3??H++HCO3- HCO3-??H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S??H++HS- HS-??H++S2-[来源:.Com] | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4??H++H2PO4- H2PO4-?H++HPO42- HPO42-??H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
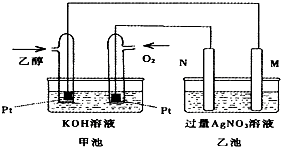 如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )
如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )| A、M电极的材料是石墨 |
| B、若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C、在此过程中,甲池中OH-向通乙醇的一极移动 |
| D、在此过程中,乙池溶液中电子从M电极向N电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、电解MgCl2溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学研究性学习小组的同学在学习了氨气的性质后讨论,既然氨气具有还原性,能否与H2还原CuO一样呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列实验:
某校化学研究性学习小组的同学在学习了氨气的性质后讨论,既然氨气具有还原性,能否与H2还原CuO一样呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com