
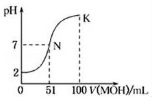
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和.
A.根据0.01mol/L的HA溶液的pH=2可知,HA在溶液中完全电离,则HA为强电解质,恰好反应需要碱50ml,溶液呈酸性分析,而K点溶液显示碱性,氢氧根离子抑制了水电离电离,MOH的物质的量大于HA的物质的量,说明MOH是弱碱;
B.N点为中性溶液,结合溶液中电荷守恒分析判断;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度;
D.电荷守恒判断溶液中离子浓度大小.
解答 解:A.0.01mol•L-1 HA溶液中pH=2,则HA是强酸,5ml碱溶液恰好反应后,溶液呈酸性,51ml恰好溶液呈中性,K点溶液为MA和MOH,溶液呈碱性,说明碱为一元弱碱,故A正确;
B.N点时溶液呈中性,溶液中存在电荷守恒得到,溶液中c(M+)=c(A-)>c(H+)=c(OH-),故B正确;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.在K点时混合溶液体积是碱溶液的2倍,根根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(OH-)>c(H+),c(M+)<c(A-),当MOH少量时只能是c(M+)>c(A-)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
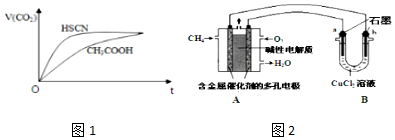
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
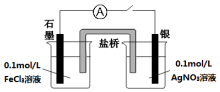
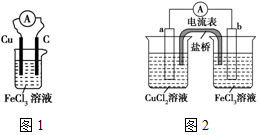 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物是重要的化工原料,在工农业生产应用广泛.
硫及其化合物是重要的化工原料,在工农业生产应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 4:5 | C. | 6:2 | D. | 2:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com